Показаны важная роль анаэробного образования сукцината при аноксичееких и гипоксических состояниях, а также активация окисления сукцината в условиях гипоксии. Сделан вывод, что для поддержания знергсжки животных клеток в условиях кислородного голодания при аноксии и гипоксии целесообразно использовать субстраты, способные участвовать в анаэробном образовании сукцината, тогда как в гипоксическнх условиях имеет смысл использовать собственно сукцинат.
Ключевые слова: анаэробные процессы, гипоксия, митохондрии, субстраты.
Кислородное голодание встречается при многих физиологических состояниях и заболеваниях сердечно- сосудистой системы, легких, крови, отравлениях различными лекарственными препаратами и ядами. В зависимости от глубины кислородного голодания различают гипоксию и аноксию. На уровне митохондрии (MX) состояния гипоксии и аноксии отличаются по степени восстановленности дыхательных переносчиков. При аноксии, характеризующейся отсутствием доставки кислорода к клеткам, все переносчики дыхательной цепи полностью восстановлены. При гипоксии, когда частично сохранена доставка кислорода, наиболее удаленные от кислорода пиридин-нуклеотиды - НАД и НАДФ, как правило, восстановлены на 100%, тогда как часть флавопротеидов и цитохромныи участок дыхательной цепи остаются в значительной мере окисленными [1,2]. Такие различия в степени восстановленности пиридиннуклеотидов и флавопротеидов позволили предположить [З], что в условиях гипоксии имеется возможность для преимущественного окисления янтарной кислоты, поскольку, сукцинатдегидрогеназа в отличие от большинства других дегидрогеназ является флавинзависимым ферментом. При этом всегда возникал вопрос, откуда берется сукцинат, если НАД- зависимые субстраты окисляться не могут. С другой стороны, известно, что в аноксических условиях сукцинаг не окисляется, а накапливается в результате образования из НАД-зависимых субстратов и аминокислог [4 -7]. Мы предположили, что анаэробное образование сукцината (АОС) можег идти не только при аноксии, но и при гипоксии.
Цель настоящей работы заключалась в анализе функционального значения образования и окисления янтарной кислоты при кислородном голодании. Рассмотрим сначала аноксические условия. Аноксию моделировали in vitro путем инкубации густой суспензии MX (15 20 мг белка на мл) в закрытой ячейке, когда за несколько секунд МX полностью восстанавливают растворенный в инкубационной среде кислород, либо путем внесения в инкубационную среду антиминина А, блокирующею дыхательную цепь на уровне циюхрома b, что предотвращает окисление в дыхагельнои цепи как пиридиннуклеотидов, так и флавопротеидов.
Образование сукцината из различных субстратов измеряли методом Н-ЯМР-спектроскопии [7]. Оказалось, что АОС в изолированных митохондриях печени, сердца и коркового слоя почек крысы интенсивно идет из а-кетоглутаpaтa с малатом, а-кетоглутарата с аммонием и из малата (рис. 1).
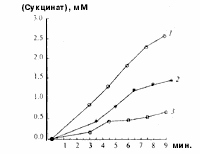 |
 |
В митохондриях печени морской свинки кроме указанных
источников сушественный вклад в процесс АОС вносит
фосфоенолпируват в присутствии бикарбоната.
В литературе доминирует представление о том, что
адаптивная роль АОС обусловлена поддержанием
образования богатых энергией соединений. Однако
выполненые нами исследования [8,9] показали, что
энергетический выход процесса АОС мал и в лучшем
случае способен лишь затормозить падение oтношения
АТФ/АДФ и величины трансмембранного электрохимического потенциала ионов водорода в
изолированных MX. Но на уровне клеток активация
АОС в присутствии глюкозы оказалась энергетически
весьма эффективной: существенно препятствовала
падению отношения АТФ/АДФ в изолированных
кардиомионитах и культивируемых клетках почки [Ч].
Сопоставив полученные данные с литературными
данными, мы предположили, что АОС траст особую
адаптивную роль в клетках животных. Не исключая из
рассмотрения собственный вклад ДОС в энергетику клеток, можно
полагать, чю зтот процесс выполняет также роль
дополнительного акцептора воссгановительных
эквивалентов, обеспечиваюшего их отток из цитозоля,
из реакций гликолитичсской оксидоредукции,
например, так, как это показано на рис.2.
В результате
может поддерживаться высокая активность гликолиза
при относительно небольшом приросте лактата. Соответственно конечными продуктами анаэробного
обмена при этом являются не только лактат и пируват,
но еще аланин и сукцинат.
Не исключено, что повышение устойчивости клеток
и MX к аноксии при активации АОС обусловлено тем,
что процесс АОС обеспечивает протекание ряда
ферментативных реакций в цикле трикарбоновых
кислот и в дыхательной цепи, несмотря на отсутствие
кислорода. Поддержание редокс-превращений субтратов и дыхательных переносчиков является важным
фактором морфофункциональной стабилизации MX
(10).
Анализ гипоксической ситуации мы провели на
двух моделях:
1) при инкубации MX в среде с
пониженным в шесть раз парциальным давлением
кислорода и
2) при торможении дыхательной цепи MX
ротеноном, блокирующим перенос восстановительных
эквивалентов от пиридиннуклеотидов до
флавопротеидов, вследствие чего создастся ситуация,
подобная гипоксии: восстановленные
пиридиннуклеотиды и соответственно НАД-зависимые
субстраты окисляться не могут, а флавопротеиды
сохраняются в окисленном состоянии.
Оказалось, что в условиях ротенонового блока
может происходить дисмутация а-кетоглутарата в
присутствии аммония (реакция 5 на схеме рис.2), что
проявляется в виде poтеноннечувствительного
дыхания, ингибируемого малонатом (11).
Другие
субстратные композиции, также и даже в большей мере,
чем дисмутация а-кетоглутарата, способны
поддерживать на фоне ротенонового блока генерацию
трансмембранного потенциала, подобно экзогенному
сукцинату (рис.3). Отсюда мы сделали вывод, что реакции АОС могут происходить не только в условиях
аноксии при полном восстановлении дыхательной цепи,но и в том случае, когда имеется достаточно высокий
уровень восстановленности пиридиннуклеотидов при
гипоксии.
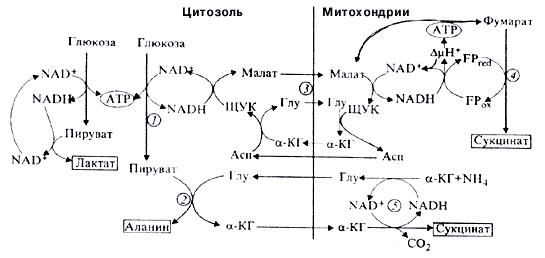
Рис.2. Схема возможного взаимодействия гликолитической оксидоредукции (1) некоторых реакций АОС {4,5}. Показано уменьшение
образования лактата при вовлечении части пирувата в переаминирование (2) при использования
восстановительных эквивалентов,
поставляемых малат-аспартатным челноком (3). в реакциях восстановительного обращения цикла трикарбоновых
кислот до сукцината (4)
и в анаэробной дисмутации а-кетоглутарата (5).
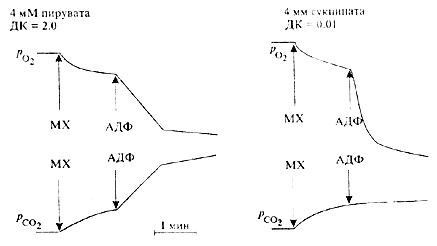
Для решения вопроса о возможности ускорения окисления
сукцината относительно НАД-зависимых субстратов в
гипоксических условиях мы использовали подход,
позволяющий по скоростям потребления кислорода и
образования углекислого газа отличать окисление сукцината
от пирувата, а-кетоглутарата или изоцитрата. Как показано на
рис.4, скорости дыхания и окислительного фосфорилирования
при окислении сукцината намного выше, чем при окислении
пирувата. Окисление пирувата сопряжено со значительным
выделением в среду углекислоты, соответственно величина
дыхательного коэффициента ДК достигает 2,0.
Тогда как при окислении сукцината величина ДК нс
превышает 0,01. Таким образом, по характерным
кинетическим кривым регистрации потребления кислорода и
образования СО2 можно уверенно отличать окисление
пирувата (а также а-кегоглутарата или изоцитрата) от
окисления сукцината.
В случае совместного внесения в инкубационную среду
обоих субстратов, при последовательном увеличении
отношения сукцицат/пируват происходило быстрое падение
ДК и АДФ/0 с одновременным увеличением скоростей дыхания и степени восстановления трансмембранного
потенциала после фосфорилирования АДФ, что характерно
для сукцината (таблица1).
Возможно, это отражает предпочтительное окисление
сукцината, хотя величина Км для сукцината в
нормоксических условиях выше, чем для пирувата (таблица2).
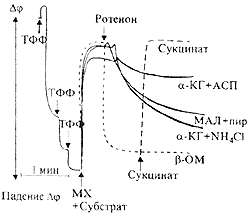
Рис.3. Изменение мембранного потенциала, измеренного по
распределению липофильного катиона тетрафенилфосфония (ТФФ)
между средой и матриксом MX печени, под влиянием
ротенона и экзогенных субстратов (сукцината и субстратов -
источников АОС). Условия инкубации, как на рис.1. Концентрация
MX 4 мг белка на мл. Видно, что ЦАД-эаииснмые субстраты,
способные участвовать в АОС, в отличие от б-оксимасляной кислоты,
в разной степени поддерживают мембранный потецциал,
подобно добавке сукцината.
 При снижении Ро2 в инкубационной среде
от 150 до 25 мм рт.ст. - условия, в которых может
возрастать степень восстановленности
пиридиннуклеотидов [ 5 ], - константа сродства для
сукцината существенно снижалась, а для пирувата
возрастала (табл.2).
При снижении Ро2 в инкубационной среде
от 150 до 25 мм рт.ст. - условия, в которых может
возрастать степень восстановленности
пиридиннуклеотидов [ 5 ], - константа сродства для
сукцината существенно снижалась, а для пирувата
возрастала (табл.2).
Возможно, это отражает изменение
как активности транспортных систем MX, так и
соответствующих дегидрогеназ, в частности
активацию сукцинатдегидрогеназы при увеличении
степени восстановленности дыхательных переносчиков и, напротив,
торможение окисления НАД-зависимых субстратов при
росте отношения НАДН/НАД. Такое увеличение
сродсгва к сукцинату при снижении PQ хорошо
согласуется с ранее полученными нами данными о
значительном (на 45 %) снижении содержания
сукцината в ткани печени крыс, находившихся в
течение 15-30 мин. в условиях гипоксии (в барокамере
на высоте 8000 м).
Таблица 1. Изменение скоростей дыхания митохондрий печени, дыхательного коэффициента, отношения АДФ/0 и степени
восстановления трансмембранного потенциала после фосфорилирования добавленного АДФ в зависимости от соотношения
экзогенных сукцината и пирувата в инкубационной среде.
 |
 |
Таблица 2. Сравнение кажущихся констант сродства для
сукцината и пирувата, рассчитанных в oбратных координатах
1/S и 1/V Лайнуивера-Бэрка по скоростям потребления
кислорода изолированными митохондриями печени крысы.
 |
Представленные данные свидетельствуют о важной
роли анаэробного образования сукцицата при
аноксических и гипоксических состояниях, а также об
активации окисления сукцината в условиях гипоксии.
Отсюда следует, что в качестве средств поддержания
энергетики животных клеток в условиях кислородного
голодания при ацоксии и гипоксии целесообразно
использовать субстраты, способные участвовать в
анаэробном образовании сукцината, тогда как в
гипоксических условиях имеет смысл использовать
собственно сукцинат.
СПИСОК ЛИТЕРАТУРЫ
1. Schotz R.. Thiirman R. G.,WiUamwn J.R., Chance В.
Burlier T. II S. Biol. Chem.1969. V. 2-1.4, © 9 Р. 2317-2324.
2. Лукьянова Л.Д., Балмуханов Б.С., Уголев А.Т. Кислородзависимые
процессы в клетке и ее функциональое состояние. М.: Наука, 1982,
301 с.
3. Кондрашова М.Н.. Маевский Е.И., Бабаян Г В., Саакян И.Р..
Ахмеров Р.Н. // Митохондрии. Биохимия и ультраструктура. М:
Наука, 1973 С, 112-129.
4. Taeglmeyer H. // Cue. Res. 1978. V 43. Г. 808-815.
5. Хочачка П., Сомеро Дм. Биохимическая адаптация. М.: Мир, 1988. 568с.
6. Рenney D.G., Cascarana J. // Biocheni. J. 1970. V. 118. Г 221-227.
7. Писаренко О.И.. Хлопков В. Н.//., Рууге Э.К. // Биохимия. 1986. Т. 51.
С.1174-1179.
8. Маевский Е.И.. Гришина Е.В., Окон М.С., Кутышенко В.П.
//Фармакологическая коррекция гипоксических состоянии. М.,
1989, С. 80-86.
9. Гришина Е.В. Энергетическая эффективность различных путей
анаэробного образования сукцината в митохондриях животных:
Автореф. дис....канд. биол. наук Пущино, 1997
10. Лузиков В.Н. Регуляция формирования митохондрий. М.Наука, 1980, 316 с.
11. Кондрашова М.Н., Маевский Е.И. Митохондриальные процессы во временой жизнедеятельности.
Пущино, 1978, С. 6-12.



 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки
