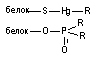С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
ГЛАВА 1.4. СВОЙСТВА ТОКСИКАНТА, ОПРЕДЕЛЯЮЩИЕ ТОКСИЧНОСТЬ
Токсичность разных веществ не одинакова. Поскольку она проявляется во взаимодействии ксенобиотика с биологической системой, её величина зависит от свойств как токсиканта, так и биосистемы и в конечном итоге определяется:
1. Способностью вещества достичь структуры-мишени, взаимодействие с которой инициирует токсический процесс;
2. Характером и прочностью связи, образующейся между токсикантом и структурой-мишенью;
3. Значением структуры-мишени для поддержания гомеостаза в организме.
Строение биологических систем, особенности их морфо-функциональной организации в значительной степени неизменны в масштабах исторически обозримого времени. В этой связи, поскольку вещество обладает вполне определенными свойствами, оно оказывает на организм (биологическую систему) воспроизводимый с известным постоянством эффект. Изменение свойств действующего фактора (воздействие другим веществом) будет сопровождаться качественными и/или количественными изменениями развивающихся эффектов. Важнейшим принципом токсикологии является зависимость качественных и количественных характеристик развивающегося токсического процесса от строения действующего вещества.
Строение вещества определяет размеры молекулы, её массу, растворимость, летучесть, агрегатное состояние при нормальных условиях и химическую активность. Все эти свойства влияют на токсичность вещества, вместе с тем, ни одно из них не является единственно значимым.
1. Размеры молекулы
Размеры молекулы токсиканта оказывают влияние на его биологическую активность в силу ряда причин:
а). С увеличением молекулярной массы затрудняется процесс поступления токсиканта в организм и распределения его в органах и тканях.
Низкомолекулярные, инертные в химическом отношении вещества в виде газа или в форме раствора, как правило, легко проникают в кровь через лёгкие, желудочно-кишечный тракт, иногда и кожу, быстро распределяются в тканях, проходя через гистогематические барьеры. Однако уже для низкомолекулярных соединений способность проникать через барьеры во многом определяется растворимостью. Гидрофильные молекулы даже с молекулярной массой 50 - 100 Д обладают ограниченной способностью проникать, например, через слизистые оболочки.
Для высокомолекулярных соединений процесс прохождения через барьерные структуры, как правило, затруднен. С другой стороны липофильные вещества, порой, не смотря на большие размеры молекул, относительно легко проходят через биологические барьеры. Большие молекулы веществ плохо растворимых в воде и липидах (искусственные и естественные полимеры) практически не проникают во внутренние среды организма и, следовательно, не обладают общетоксическим действием.
б). С увеличением молекулярной массы увеличивается число возможных изомерных форм молекулы токсиканта и, одновременно, возрастает специфичность их действия.
Поскольку структуры организма, вступающие во взаимодействие с токсикантом, в большинстве случаев имеют вполне определённую пространственную организацию, активность действующего вещества существенно зависит от его конформации. Чем больше молекула, тем отчетливее выступает эта зависимость. Так, низкомолекулярные предельные углеводороды и некоторые их производные действуют практически неспецифично, причем, как на одноклеточные, так и на сложно организованные многоклеточные организмы. Малые размеры этих молекул обусловливают ограниченное количество их изомерных форм, а следовательно увеличивают количество участков их неспецифического связывания в организме.
С увеличением размеров молекул веществ возрастает число токсикантов, имеющих одинаковую массу и близкое строение, но обладающих совершенно различной токсичностью. Так, из более чем 100 изомеров тетрахлор-пара-дибензодиоксина, высокой токсичностью обладает лишь один: 2,3,7,8-тетрахлор-пара-дибензодиоксин.
Для группы высокомолекулярных веществ (полимеры), однако, также достаточно характерно неспецифическое действие. Оно может быть обусловлено, например, модификацией коллоидно-осмотического давления крови.
в). С увеличением размеров молекулы возрастает вероятность взаимодействия токсикантов с биосубстратом за счет сил Ван-дер-Ваальса (см. ниже).
Чем больше размеры молекулы, тем большее число атомов токсиканта контактирует с участком его связывания, тем прочнее формирующаяся при этом связь. Поскольку большие молекулы обладают известной "гибкостью", это в ещё большей степени способствует "прижиманию" лиганда к рецептору, то есть увеличению его афинности. В основном за счет сил Ван-дер-Ваальса нейромедиаторы, гормоны (и другие эндогенные биорегуляторы) взаимодействуют с рецепторным аппаратом клеток, органов, тканей. Однако силы эти, как правило, не велики и сразу после воздействия происходит диссоциация комплекса биорегулятор-рецептор. Отдельные токсиканты, напоминающие строением эндогенные биологически активные вещества, также вступают во взаимодействие с рецепторами, имитируя (агонисты) их эффекты. Такой механизм лежит в основе токсического действия многих алкалоидов (никотина, анабазина и др.), гликозидов, синтетических токсикантов и т.д. Если токсикант имеет существенно большие размеры, чем естественный агонист, то за счет сил Ван-дер-Ваальса осуществляется его прочная фиксация на рецепторе. Это приводит к экранированию рецепторов от действия агонистов, их блоку (антагонисты). Так действуют, например, атропин и курарин на, соответственно, М- и Н-холинорецепторы, ДЛК - на рецепторы серотонина, и т.д. Среди токсичных веществ значительно большее число является антагонистами соответствующих молекул-биорегуляторов.
2. Геометрия молекулы токсиканта
Химическая формула, как правило, несет недостаточно информации о свойствах вещества, в частности о геометрии молекулы. Вместе с тем изучение зависимости "строение - активность" в токсикологии возможно только с учетом представлений о пространственной организации молекул токсиканта.
Молекулы веществ могут быть ригидными и гибкими. Ригидные молекулы имеют постоянную пространственную организацию. Это прежде всего вещества, образованные циклическими радикалами, содержащие поливалентные мостиковые связи (алкалоиды, полигалогенированные дибензофураны, бенз(а)пирен и многие другие). Конформация "гибких" молекул, содержащих в структуре алифатические цепи, группы, соединенные простыми связями, всегда неопределенна, за счет постоянного изменения во времени взаиморасположения радикалов. Однако и у этих веществ порой можно выделить предпочтительную конформацию. Так, наиболее вероятна форма молекулы 1,2-дихлорэтана, при которой атомы хлора находятся в наибольшем удалении друг от друга (транс-изомер) (рисунок 1).
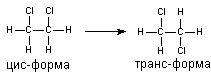
Рисунок 1. Цис- и транс-форма дихлорэтана
Большое количество химических веществ, отличающихся высокой токсичностью, существует в форме изомеров. Основные формы изомерии это: структурная, оптическая, геометрическая, таутомерия (проблема глубоко рассматривается в современных курсах "Общей химии").
У низкомолекулярных веществ, таких как дихлорэтан, различия пространственной организации изомеров незначительно сказываются на их биологической активности. Как уже указывалось, такие молекулы, по большей части, вызывают малоспецифичные эффекты: например, нарушение проницаемости возбудимых биологических мембран, образование ковалентных связей с молекулами белков, нуклеиновых кислот и т.д. Значительные различия наблюдаются при действии крупных молекул токсикантов, преимущественно взаимодействующих с определённым образом пространственно организованными специфическими рецепторами для эндогенных биорегуляторов. Так, если оценить размеры большинства известных нейромедиаторов, то выясняется, что молекулярная масса большинства из них лежит в интервале 160 - 190 Д. Молекулы ацетилхолина и адреналина состоят из 26 атомов, серотонина - 25, норадреналина - 23. Естественно ожидать, что и токсиканты, взаимодействующие с рецепторами этих нейромедиаторов, должны иметь близкие размеры и, следовательно, вполне определенную пространственную организацию. В этом случае роль изомерии в биологической активности веществ возрастает. Аналогичны рассуждения применительно к токсикантам - конкурентным ингибиторам многих ферментов (например, ингибиторам ацетилхолинэстеразы: фосфорорганическим соединениям и карбаматам). Основные закономерности, определяющие влияние изомерии на токсичность веществ состоят в следующем:
1. Чем специфичнее взаимодействие вещества и рецептора, тем отчетливее различия в действии изомеров. Поскольку токсичность в значительной степени определяется специфичностью взаимодействия токсиканта со структурами-мишенями, имеющими большое значение в поддержании гомеостаза в организме, можно утверждать, что чем выше токсичность вещества, тем существеннее различия биологической активности его изомеров.
2. Если асимметричный атом в молекуле токсиканта занимает ключевую позицию, определяющую во многом его эффект, то различия в действии изомеров, как правило, существенны. И напротив, если асимметричный атом находится в положении, не определяющем биологический эффект, то стереоизомеры обладают практически одинаковой токсичностью.
3. Чем жестче конформация рецептора, тем более выражены различия активности, действующих на него изомеров токсиканта. Так, структурная гибкость Н-холинорецепторов ганглионарных и нейромышечных синапсов выражена на столько, что стереоизомеры веществ, взаимодействующих с ними, обладают практически одинаковой активностью.
Различия в токсичности стереоизомеров могут быть связаны не только с особенностями их токсикодинамики, но и токсикокинетики (активный транспорт через мембраны, метаболизм). Так, алкалоид L-скополамин быстро разрушается эстеразой плазмы крови кролика на L-троповую кислоту и тропин (скопин), утрачивая биологическую активность. D-скополамин не разрушается энзимом и поэтому действует значительно дольше.
3. Физико-химические свойства вещества
Физико-химические свойства веществ существенным образом сказываются на их токсичности. Определяющими являются: растворимость в воде, растворимость в липидах, кислотно-основная природа токсиканта.
А. Растворимость в воде.
Растворимость токсиканта в воде - необходимое условие его резорбции во внутренние среды организма: corpora non agunt nisi soluta (что не растворяется, то не действует). Для того, чтобы достичь структуры-мишени токсикант также должен попасть в водную фазу, так как вода - основа межклеточной жидкости организма. Полярность молекулы воды требует и от токсиканта известной полярности. Поэтому растворимость вещества в воде зависит от наличия и количества в его молекуле полярных групп и их строения (таблица 1).
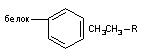
Таблица 1. Растворимость некоторых производных бензола в воде (г/100г; С300)
R |
-C2H5 |
-J |
-Br |
-Cl |
-CH3 |
-F |
-NO2 |
-SO3H |
г/100г |
не раств. |
0,034 |
0,045 |
0,049 |
0,057 |
0,15 |
0,19 |
раств. |
Некоторые вещества проявляют свойства кислот или оснований и, следовательно, могут находиться в растворе в протонированной или депротонированной форме. Это также сказывается на их растворимости (рисунок 2).
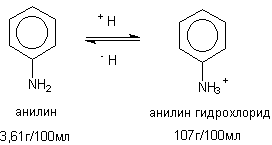
Рисунок 2. Растворимость анилина и его протонированного производного
Как видно из приведенного рисунка, наличие заряда в молекуле токсиканта существенно сказывается на его способности растворяться в воде, усиливая диполь-диполь взаимодействие растворителя и растворенного соединения.
Б. Растворимость в липидах.
Растворимость в липидах имеет основное значение для процессов проникновения и распределения больших молекул токсикантов в организме. Кроме того, чем выше растворимость вещества в липидах, тем хуже оно выводится из организма. Мерой жиро-растворимости токсикантов является количество вещества, способное к растворению в единице объема жидких масел или органических растворителей. При анализе получаемых результатов следует иметь в виду, что в различных растворителях вещество растворяется по-разному. Так, растворимость амидопирина (г/100г; 370С) в бензоле составляет 0,81; в топленом сале - 1,7; растительном масле - 2,0; смеси бензола и лецитина (1:1) - 12,6; хлороформе - 120,6.
Нерастворимые в жирах молекулы могут попасть в организм из окружающей среды лишь в том случае, если они проходят через поры биологических мембран, либо переносятся через барьеры с помощью специальных механизмов, например, пиноцитоза и т.д. (см. раздел "Токсикокинетика").
Большие, нерастворимые в липидах вещества, как правило, относятся к числу малотоксичных.
Жирорастворимость и водорастворимость - связанные между собой свойства. Чем полярнее молекула вещества, тем лучше она растворяется в воде и хуже - в липидах. Наибольшей биологической активностью, как правило, обладают токсиканты с промежуточной растворимостью. В этой связи важной для токсикологии характеристикой является коэффициент распределения вещества в средах: масло/вода или гептан/вода. Для некоторых веществ их биологическая активность пропорциональна величине этого коэффициента (таблица 2)
Таблица 2. Зависимость токсичности алифатических спиртов от их жиро- и водорастворимости *.
Параметры |
СН3ОН |
С2Н5ОН |
С3Н7ОН |
С4Н9ОН |
С5Н11ОН |
С6Н13ОН |
С8Н17ОН |
ЛД50 в/в (мМ/кг) |
177 |
53,7 |
18,2 |
5,09 |
2,09 |
1,01 |
0,53 |
Гемолиз эритроцитов |
7,43 |
4,11 |
0,80 |
0,44 |
0,18 |
0,06 |
0,02 |
Угнетение активности каталазы на 50% (М) |
3,6 |
3,47 |
2,36 |
1,95 |
1,33 |
- |
- |
* - жирорастворимость увеличивается с увеличением молекулярной массы спирта.
Четкую корреляцию можно проследить лишь в гомологичных рядах токсикантов, при этом оцениваемые эффекты, как правило, неспецифичны (денатурация энзима, нарушение свойств биологических мембран, наркоз, повреждение клетки, смерть).
Для специфического взаимодействия токсиканта со структурой-мишенью растворимость в воде или липидах имеет неупорядоченное значение.
В. Кислотно-основная природа токсиканта.
Многочисленные токсиканты являются слабыми кислотами или основаниями, то есть могут, в зависимости от рН среды, находиться в протонированной или депротонированной форме. Кислоты, находясь в протонированной форме - незаряженные молекулы, азотистые основания, напротив, представляют собой катионы. В депротонированной форме кислоты представляют собой анионы, а основания - не заряжены. Сила кислоты или основания определяется способностью к диссоциации, которая характеризуется величиной константы диссоциации (Ка или рКа - отрицательный десятичный логарифм значения Ка). Чем выше значение рКа, тем легче осуществляется процесс протонирования вещества. Основания с высоким значением рКа - более сильное основание; кислота с высоким рКа - слабая кислота. Так, диметиламин (рКа 10,7) - более сильное основание, чем N-метиланилин (рКа 4,7); фенол (карболовая кислота рКа 9,9) - более слабая кислота, чем бензойная кислота (рКа 4,2). Соотношение ионизированной и неионизированной форм токсиканта в среде помимо величины рКа, определяется рН среды. С увеличением рН увеличивается число незаряженных молекул оснований и заряженных анионов кислот.
Часто ионизация токсиканта сопровождается усилением его сродства к рецептору, однако одновременно затрудняется прохождение молекулы через биологические барьеры.
Сильные кислоты и щелочи (полностью диссоциирующие в водных растворах), при действии на ткани организма, резко изменяя рН, вызывают денатурацию макромолекул клеток. Этот процесс лежит в основе химического ожога покровных тканей.
4. Стабильность в среде
Биологическое действие токсикант может оказывать лишь при условии его достаточной стабильности в окружающей среде и средах организма. Если вещество нестабильно, то развивающийся эффект связан с воздействием продуктов его превращения. Активные в химическом отношении вещества редко становятся непосредственными причинами общетоксического действия. Эти вещества, либо уже в окружающей среде вступают в химические реакции, превращаясь в более инертные, но относительно стабильные соединения, либо реагируют с покровными тканями организма (кожей, слизистыми), растрачивая свой химический потенциал на их альтерацию (местное действие).
После попадания в организм большая часть ксенобиотиков с различной скоростью подвергается биотрансформации. Так, при поступлении в желудочно-кишечный тракт пептиды и белковые молекулы (например, тетанотоксин) быстро инактивируются пептидазами и протеиназами. В процессе разрушения токсикантов различного строения участвует и кишечная флора. Метаболизм ксенобиотиков завершается в крови и тканях после их резорбции. Поэтому, порой, очень трудно решить, какое именно вещество является непосредственно действующим началом развивающегося токсического процесса.
5. Химические свойства.
Взаимодействие токсиканта с молекулами-мишенями организма подчиняется тем же закономерностям, что и любая другая химическая реакция, протекающая ex vivo и, следовательно, во многом зависит от его химических свойств.
Большинство высоко токсичных соединений - инертные в химическом отношении молекулы. Сила межмолекулярного взаимодействия между токсикантом и биологической молекулой-мишенью действует, как правило, локально; образующаяся связь способна к диссоциации. Высвободившаяся из связи с токсикантом биомишень восстанавливает исходные свойства. В подобных случаях достаточно элиминировать не связавшуюся часть токсиканта из организма для того, чтобы сдвинуть химическое равновесие в сторону разрушения комплекса токсикант-мишень, и, тем самым, устранить действие яда.
Иногда между токсикантом и молекулой-мишенью образуются прочные связи. В этих случаях разрушить комплекс токсикант-биомишень порой возможно только с помощью других средств, образующих с ядом еще более прочные комплексы. В частности, для восстановления активности ацетилхолинэстеразы, ингибированной фосфорорганическими соединениями (ФОС), применяют вещества из группы оксимов, вступающие во взаимодействие с токсикантами и вызывающие тем самым дефосфорилировани активного центра энзима.
5.1. Типы химических связей, образующихся между токсикантами и молекулами-мишенями организма
При взаимодействии токсиканта с биологическими структурами-мишенями могут образовываться различные типы химических связей (таблица 3).
Таблица 3. различные типы связей, формирующихся между токсикантами и молекулами-мишенями организма
Вид связи |
Пример |
Энергия связи |
Ионная |
|
20 |
Ковалентная |
|
40 - 600 |
Донорно-акцепторная |
|
4 - 20 |
Ион-дипольная |
|
8 - 20 |
Диполь-дипольная |
|
4 - 12 |
Водородная |
|
4 - 28 |
Ван-дер-Ваальса |
|
1 - 4 |
Гидрофобная |
|
1 - 6 |
Ионная связь. В водных растворах многие вещества диссоциируют с образованием ионов. Между положительно и отрицательно заряженными ионами токсиканта и эндогенными ионами-мишенями начинают действовать силы электростатического притяжения. Вследствие притяжения возникает химическая связь. Связь такого типа называется электровалентной или ионной. Образованные катионами и анионами вещества не несут электрического заряда.
А- + В+ ![]() АВ
АВ
Токсические последствия подобного взаимодействия в организме развиваются в случае образования не растворимого в воде комплекса иона-токсиканта с биологически значимым ионом-мишенью. Например, при интоксикации фторидами, ион фтора может вступать во взаимодействие с ионом кальция. В итоге образуется нерастворимый фторид кальция. Развивающаяся гипокальциемия имеет определенное значение для развития и проявления интоксикации. Аналогичным образом действует щавелевая кислота, образующаяся в организме в процессе метаболизма этиленгликоля при интоксикации последним:
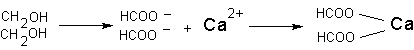
Поскольку степень диссоциации многих веществ в водном растворе существенно зависит от рН среды, количество образовавшихся за счет ионной связи комплексов токсикант-мишень также зависит от этого показателя.
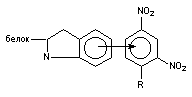
Ковалентная связь. Для образования ковалентной связи, взаимодействующие атомы должны иметь на внешней электронной орбите неспаренные электроны. Эти электроны занимают одну и ту же орбиталь, а образовавшаяся общая пара формирует силу притяжения между атомами. В результате образования такой общей пары электронов каждый из взаимодействующих атомов приобретает "завершенный набор" электронов и образовавшееся соединение становится стабильным. Энергия ковалентной связи велика и составляет 200 - 400 кдж/мол
Высокая стабильность связи этого типа означает практически необратимый характер присоединения токсиканта к структуре-мишени. Примерами веществ, образующих с биомолекулами подобную связь, являются ФОС (взаимодействуют с серином, входящим в структуру активного центра ацетилхолинэстеразы), иприты (взаимодействуют с пуриновыми основаниями нуклеиеновых кислот), а также целый ряд других распространённых токсикантов (метилбромид, метилхлорид, этиленоксид и др.). Вследствие прочности образовавшейся связи, разрушение комплекса токсикант-биомишень возможно только с помощью специальных средств (например, реактиваторов ХЭ при интоксикации ФОС). Восполнение содержания поврежденной токсикантом биологической структуры возможно также за счет синтеза её de novo. Так, восстановление активности АХЭ в тканях лабораторных животных отравленных зоманом проходит со скоростью синтеза энзима нервными клетками.
Координационная связь - это ковалентная связь, в которой обобществленною пару электронов предоставляет только один из участвующих в связи атомов. Один из атомов является донором, а другой акцептором электронной пары, поэтому эту связь называют также донорно-акцепторной. Акцепторами часто являются катионы металлов, или атомы переходных металлов (Zn, Cu, Fe), входящих в состав молекулы. Таким образом, в частности, оксид углерода взаимодействует с железом гемоглобина, с образование карбоксигемоглобина.
Водородная связь. Ковалентная связь между атомом водорода и электроотрицательным атомом (кислород, азот, сера и т.д.) более или менее поляризована
![]()
Вследствие этого атом водорода приобретает незначительный положительный заряд. Если в близи такого атома находится молекула или группа, содержащая анион или электроотрицательный атом, между ними образуется слабая связь, называемая водородной.
Водородная связь может образовываться как между молекулами, так и между атомами внутри молекул. Энергия связи не велика и в водном растворе составляет около 20 кдж/мол. Её прочность во многом зависит от строения взаимодействующих веществ, в частности, от степени электроотрицательности атомов, связанных с водородом. Электроотрицательность атомов возрастает в ряду:
Н = P < C = S = I < Br < Cl = N < O < F
2,1 2,1 2,5 2,5 2,5 2,8 3,0 3,0 3,4 4,0
Водородные связи имеют очень большое значение для поддержания пространственной структуры белков, нуклеиновых кислот и других высокомолекулярных соединений. Вещества, способные разрушать водородную связь, могут нарушать пространственную структуру макромолекул (явление интерколации: встраивание молекул акридина, этидиумбромида между плоскостями, образуемыми витками спирали молекулы ДНК).
В состав молекул токсикантов также входят группы, способные участвовать в образовании водородных связей. Если эти группы (Х-Н) являются структурными элементами "активного" радикала токсиканта, то они участвуют в образовании сложной связи вещества с молекулой-мишенью. Поскольку водородные связи являются по сути электростатическими, их сила ослабевает в присутствии веществ, обладающих свойствами диэлектриков ("неэлектролитов").
Связи Ван-дер-Ваальса. Форма электронного облака молекул квазистабильна, то есть не изменяется до тех пор, пока на неё не действуют внешние силы. Под влиянием электромагнитных полей электронные облака молекул деформируются. При этом безразлично вызвано ли появление деформируящих сил воздействием внешних полей или поле сформировано близлежащими ионами, диполями, аполярными молекулами. Степень деформированности электронного облака зависит от энергетических характеристик воздействующих полей и поляризуемости самой молекулы. Способность электронного облака к деформации (поляризуемость) зависит от размеров молекулы. У больших молекул она больше, чем у малых, поскольку сместить электроны, находящиеся на значительном удалении от ядра атома, легче.
Деформирующее воздействие полей превращает неполярные молекулы в диполи, так как центры максимальной плотности положительного и отрицательного зарядов молекулы несколько разъединяются в пространстве. Сформировавшийся диполь называют индуцированным или временным, поскольку он перестает существовать сразу после прекращения действия деформирующих сил. Две близлежащие неполярные молекулы могут взаимно индуцировать образование временных диполей и, таким образом взаимодействовать друг с другом. Силы взаимодействия, формирующиеся между временными диполями, называются силами Лондона - Ван-дер-Ваальса. Энергия образующейся связи мала, однако она существенно возрастает при увеличении числа участков контакта между взаимодействующими молекулами. Со стороны токсиканта это могут быть ароматические, гетероциклические, алкильные радикалы; со стороны рецептора - неполярные участки молекул аминокислот (лейцин, валин, аланин, пролин и др.). Вклад каждой -СН2- группы алкильной цепи во взаимодействие оценивается в 2 - 4 кдж/мол. При тесном контакте больших неполярных молекул энергия связи может достичь очень больших величин. Поэтому при образовании комплекса токсикант-биомишень силы Ван-дер-Ваальса могут обеспечивать очень прочную фиксацию ксенобиотика. Действующая сила, ответственная за формирование связи, обратно пропорциональна седьмой степени расстояния между взаимодействующими молекулами. Поэтому она не может обеспечить притяжение молекул токсиканта, свободно циркулирующих в биосредах, к рецептору. В этом процессе первостепенную роль играют силы электростатического взаимодействия. Однако после того как контакт между токсикантом и рецептором осуществился силы Ван-дер-Ваальса обеспечивают его ориентацию и плотную фиксацию.
Гидрофобное взаимодействие. Гидрофобные связи формируются в водной среде, когда молекулы взаимодействующих веществ контактируют друг с другом неполярными (гидрофобными) участками. В отличии от взаимодействия Ван-дер-Ваальса и донорно-акцепторного взаимодействия, которые также формируются при взаимодействии неполярных групп, образование гидрофобных связей обусловлено свойствами воды, без участия которой взаимодействие происходить не может. В соответствии с теорией, молекулы воды связаны друг с другом водородными связями, образуя трехмерную структуру (кластер), напоминающую структуру льда. На границе поверхности, разделяющей неполярную молекулу и молекулы воды, образование такой структуры затрудняется. При контакте двух неполярных молекул, растворенных в воде, общая площадь поверхности, разделяющей воду и эти молекулы уменьшается. Вследствие этого, мобилизуется часть молекул воды, организованных в кластер. В противоположность всем другим химическим связям и взаимодействиям гидрофобная связь, таким образом, обусловлена преобразованием растворителя (воды), а не растворенных взаимодействующих веществ. Движущей силой образования связи является рост энтропии целостной системы растворитель - растворенные молекулы. Структурная организация гидрофобных, взаимодействующих молекул возрастает (уменьшение энтропии), но при этом существенно дезорганизуется (энтропия возрастает) структура растворителя (воды).
Гидрофобные связи имеют большое значение при взаимодействии неполярных молекул ксенобиотиков с клеточными и внутриклеточными мембранами, для образования их комплексов с белками, при этом возможно нарушение конформации макромолекул.
В процессе взаимодействия низкомолекулярного вещества с биомишенью практически всегда формируется несколько типов связей (рисунок 3), поскольку молекула токсиканта, как правило, включает полярный (иногда даже ионизированный), и неполярный фрагменты.
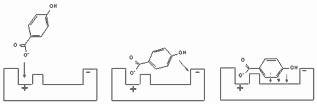 + Щелкните для загрузки увеличенной копии (2,74кб, 528x174 GIF) |
| Рисунок 3. Этапы взаимодействия молекулы токсиканта с биомишенью |
Ионные связи, за счет которых осуществляется притяжение молекулы к биомишени, мало специфичны (аналогично ион-дипольному и диполь-дипольному взаимодействию). Взаимодействие между неполярными группами также неспецифично. Однако, если в структуре мишени (например, рецепторе для эндогенных биорегуляторов) полярные и неполярные группы пространственно организованы, между этими участками и особыми участками молекулы токсиканта образуются специфичные связи, обусловленные пространственной организацией молекулы токсиканта. Такое взаимодействие можно сравнить с ориентацией намагниченых стрелок в магнитном поле. После ориентации молекулы с помощью ионного (диполь-дипольного) взаимодействия между ней и рецептором формируется тесный контакт, и образуются связи за счет водородных сил и сил Ван-дер-Ваальса. Образующийся комплекс тем более прочен, чем более комплементарна молекула токсиканта рецептору.
|