Санкт-Петербург, 2002 г.
РАЗДЕЛ 7. ИЗБИРАТЕЛЬНАЯ ТОКСИЧНОСТЬ
ГЛАВА 7.5.
Нейротоксичность
Нейротоксичность - это свойство химических веществ, действуя на организм немеханическим путем, вызывать нарушение структуры и/или функций нервной системы. В основе развивающегося токсического процесса может лежать повреждение любого структурного элемента нервной системы путем модификации пластического, энергетического обменов, нарушения генерации, проведения нервного импульса по возбудимым мембранам, передачи сигнала в синапсах. Нейротоксичность может быть проявлением прямого, и опосредованного повреждением других органов и систем, действия токсикантов на нервную систему. Нейротоксичность присуща большинству известных веществ. Поэтому практически любая острая интоксикация в той или иной степени сопровождается нарушениями функций нервной системы. Вещества, для которых порог чувствительности собственно нервной системы (отдельных её гистологических и анатомических образований) существенно ниже, чем других органов и систем, и в основе интоксикации которыми лежат нарушения моторных, сенсорных функции нервной системы, памяти, мышления, эмоций, поведения, условно относят к нейротоксикантам, даже если не известны механизмы их токсического действия. Например, интоксикация свинцом у детей приводит к замедлению умственного развития, ухудшает способности к обучению. Механизм этого феномена неизвестен, но принято считать, что нейротоксичность - свойство свинца. Изучение особенностей действия отдельных нейротоксикантов позволяет понять механизмы феномена нейротоксичности в целом.
1. Структурно-функциональная организация нервной системы
Нервная система - это сложная система, обеспечивающая межклеточное взаимодействие и контролирующая большинство функций организма. Движение, мышление, зрение, слух, деятельность сердца, дыхание и другие физиологические процессы контролируется сложноорганизованной системой нервных клеток, нервных волокон, воспринимающих раздражение структур, синаптических контактов, нейрогормонов, нейромедиаторов.
Нервная система представлена двумя отделами - центральным (центральная нервная система - ЦНС) и периферическим (периферическая нервная система - ПНС). Анатомические структуры, входящие в ЦНС, это головной мозг, оптические нервы, спинной мозг. ПНС представлена структурами автономной и соматической нервной системы (таблица 1). Все образования ЦНС и ПНС представляют собой потенциальную мишень для действия токсикантов.
Таблица 1. Основные образования центрального и периферического отделов нервной системы
Центральная нервная система: головной мозг спинной мозг оптические нервы (вторая пара черепно-мозговых нервов) Периферическая нервная система: соматический отдел : - черепно-мозговые нервы - спинальные нервы - ганглии задних корешков спинного мозга - периферические нервы: моторные нервно-мышечные синапсы специализированные сенсорные рецепторы автономный отдел: - парасимпатические краниальные и крестцовые нервы и ганглии - симпатические ганглии и нервы |
Клеточное строение ЦНС, её функции чрезвычайно сложны и многообразны. Клетки, составляющие нервную систему и определяющие её функциональное состояние, представлены нервными клетками (нейроны), глиальными клетками, эндотелиальными клетками сосудов мозга.
Нормальное функционирование нервной системы возможно только в условиях постоянства среды, окружающей нейроны. Основными характеристиками этой среды являются: адекватное снабжение кислородом, субстратами; постоянство кислотно-основного равновесия, ионного состава; нормальное внутричерепное давление.
Поддержание постоянства внутренней среды мозга обеспечивается деятельностью глиальных клеток, с помощью цереброспинальной жидкости, гематоэнцефалического барьера, благодаря мозговому кровотоку и внешнему дыханию.
1.1. Нейроны
Основные функциональные элементы нервной системы - нейроны. Они отличаются от других клеток наличием отростков - дендритов и аксонов. Дендрит, это модифицированная часть нейрона, предназначенная для восприятия нервного сигнала и его проведения. Он представляет собой многократно ветвящийся отросток, отходящий от любой части нейрона, длина которого редко превышает 1 мм. Нервная клетка может иметь один и более дендритов. Дендриты образуют сложную структурную сеть, обеспечивающую коммуникацию нервных клеток и интеграцию нервной системы.
Аксон у нервной клетки только один. Это отросток, предназначенный для проведения нервного импульса от тела нервной клетки к другим клеткам. Диаметр аксона постоянен на всём его протяжении, а длина колеблется от долей миллиметра до метра.
Тела, дендриты и аксоны нервных клеток окружены клеточной мембраной, толщина которой составляет около 70 А. В мембраны нервных клеток встроены специально организованные белковые комплексы, формирующие электро- и хемовозбудимые каналы, регулирующие проницаемость мембран для ионов Na+, K+, Cl-, Ca2+. Градиент концентрации ионов между внутренней и внешней средой клетки формирует потенциал покоя возбудимой мембраны, равный примерно 90 мв (таблица 2).
Таблица 2. Распределение ионов внутри и вне возбудимых клеток (Katz, 1971). (мМ/л)
ионы |
мышечная клетка |
нервная клетка |
||
снаружи |
внутри |
снаружи |
внутри |
|
Na+ K+ Cl- |
120 2,5 120 |
9,2 140 3 - 4 |
460 10 540 |
50 400 40 - 100 |
Градиенты концентраций калия и хлора примерно уравновешивают друг друга. Поэтому проницаемость мембраны для этих ионов хотя и ограничена, но относительно высока. Проницаемость натриевых каналов в покое ничтожно мала. Более того Na+ постоянно "выкачивается" за пределы нейрона с помощью энергозависимых механизмов против высокого электрохимического градиента. Таким образом, потенциал покоя представляет собой ни что иное, как готовый к использованию источник накопленной энергии, необходимой для генерации сигнала (потенциала действия). Если возбудимая мембрана деполяризуется примерно на 15 мв, электровозбудимые натриевые каналы открываются, проницаемость их для ионов резко возрастает, Na+ устремляется в клетку, разница потенциалов по обе стороны мембраны падает, а затем в течение около 0,8 мсек возвращается примерно к исходному уровню. При этом восстанавливается исходная проницаемость мембраны для натрия. Усиление проницаемости для К+ также необходимо для полной реполяризации мембраны и восстановления исходного потенциала покоя.
Распространяющаяся по аксону волна деполяризации мембраны с последующей её реполяризацией лежит в основе проведения нервного импульса.
Проведение сигнала не единственная функция аксона. По ходу нервного отростка с помощью механизмов быстрого аксонального тока (400 мм/день) и медленного тока (3 мм/день) осуществляется также транспорт белков, энзимов, предшественников нейромедиаторов. Возможен также ретроградный ток от периферии аксона к телу нервной клетки. Скорость ретроградного тока - около 200 мм/день. Энергетика и механизмы этого явления до конца не изучены. Не до конца охарактеризованы и вещества, транспортируемые по аксону. По-видимому, они имеют трофические функции; возможна их транссинаптическая передача от иннервируемых клеток. По механизму ретроградного тока, транссинаптически, в ЦНС могут поступать некоторые токсиканты (например, тетанотоксин).
Наличие отростков и системы внутриклеточного транспорта, предназначенной для перемещения питательных, физиологически активных и пластических материалов на значительные (в масштабах организма) расстояния, делает нейроны наиболее уязвимыми элементами нервной системы для действия токсикантов с различными механизмами действия.
1.2. Синапсы
Межклеточные взаимодействия в нервной системе осуществляется через синапсы - пространства между окончанием аксона и возбудимой мембраной иннервируемой клетки (нейрона, мышечной, железистой клетки). Сигнал в синапсе передается с помощью специального химического вещества, выделяемого нервным окончанием и называемого нейромедиатор (нейротрансмиттер). Выделившийся нейромедиатор диффундирует через синаптическую щель и связывается со специфическим рецептором на постсинаптической мембране, изменяя его свойства. Изменение свойств рецептора запускает каскад процессов в иннервируемой клетке, сопровождающихся модификацией её функционального состояния (активацией или угнетением). Например, в нервно-мышечном синапсе нервное окончание выделяет ацетилхолин, который, взаимодействуя с холинорецептором, вызывает возбуждение миоцита и его сокращение. Хорошо доказана нейромедиаторная роль таких веществ, как дофамин, норадреналин, серотонин, ацетилхолин, гамма-аминомасляная кислота (ГАМК), глутамат. Огромное количество химических веществ реализуют свое биологическое действие, вмешиваясь (активируя или угнетая) в процесс проведения нервного импульса в синапсах. Иногда такие вещества называют синаптическими ядами.
1.3. Глиальные клетки
Глиальные клетки представлены астроцитами, олигодендроцитами, клетками микроглии. Асторглия тесно ассоциирована с нервными клетками и выполняет роль стабилизатора среды, окружающей нейрон. Её значение - формирование гематоэнцефалического барьера (см. ниже).
Олигодандроциты в ЦНС и Шванновские клетки (леммоциты) ПНС окружают аксоны нейронов и образуют миелин. Миелинизирующие клетки, наряду с нейронами, чрезвычайно чувствительны к действию токсикантов, поскольку, имеют цитоплазматические отростки, в которых обменные процессы идут менее интенсивно, чем в перикарионе, а площадь поверхности, доступная для действия токсикантов, существенно больше, чем у клеток других типов. В этой связи, миелин очень часто повреждается при интоксикациях. Поражение может быть связано с первичным повреждением самого миелина (гексахлорбензол, триэтилолово и др.), либо энзимов, регулирующих его обмен (теллур, купризол). Некоторые токсиканты вызывают повреждение миелина, первично разрушая нейроны (таллий), аксоны (н-гексан), кровеносные сосуды (свинец).
Микроглия это фагоцитарная система ЦНС. Значение этих элементов глии для течения токсического процесса не известно.
1.4. Цереброспинальная жидкость.
Цереброспинальная жидкость, секретируемая хориоидальным сплетением (клетки сплетения морфологически напоминают клетки эпителия почечных канальцев), омывает желудочки мозга и резорбируется ворсинками паутинной оболочки мозга. Скорость секреции - 0,3 - 0,4 мл/мин. Абсорбция жидкости начинается при давлении, равном 68 мм водяного столба. С увеличением давления возрастает скорость абсорбции. Цереброспинальная жидкость свободно проникает через эпендиму, выстилающую поверхность желудочков, и находится в прямой связи с экстрацеллюлярной жидкостью мозга. Она распространяется между нервными клетками, очищая межклеточное пространство. Цереброспинальную жидкость называют лимфой мозга. Её состав отличается от состава плазмы крови. В то время как цереброспинальная жидкость содержит чуть больше хлоридов, натрия, бикарбоната и магния, чем плазма, в ней содержится несколько меньше мочевины, глюкозы, калия, кальция и значительно меньше белка (15 - 30 мг/100 мл). Объем цереброспинальной жидкости у взрослого человека составляет около 150 мл. В эксперименте, путем введения токсикантов непосредственно в желудочки мозга лабораторных животных (в цереброспинальную жидкость), можно обеспечить их действие на нейроны, минуя гематоэнцефалический барьер.
1.5. Гематоэнцефалический барьер.
ЦНС защищена от действия многих токсикантов гематоэнцефалическим барьером. Аналогичный барьер окружает периферический отдел нервной системы (гематоневральный барьер). Также как и в ЦНС здесь имеются анатомические структуры с повышенной проницаемостью барьера для токсикантов. К числу таких структур относятся корешки дорзальных ганглиев спинного мозга и вегетативные (автономные) ганглии.
1.6. Энергетический обмен
Масса мозга составляет 2 - 3% от массы тела, однако количество протекающей через мозг крови составляет в покое около 15% от общего объема (50 - 60 мл/мин/100 г ткани); мозг потребляет около 25% потребляемой организмом глюкозы и 20% кислорода (3,5 мл/мин/100 г ткани). Такой интенсивный энергетический обмен необходим главным образом для обеспечения ионного транспорта через клеточные мембраны с целью поддержания необходимого электрохимического градиента по обе стороны возбудимых мембран, а также для синтеза нейромедиаторов. Лишь 10 - 20% производимой энергии расходуется на поддержание структуры мозга. В эксперименте парциальное давление кислорода в крови может снижаться до 10 мм Нg и при этом структурные изменения в ткани мозга не развиваются, хотя функции будут нарушены существенно. Высокая потребность в энергии для реализации функций и минимальное энергопотребление, необходимое для поддержания структуры мозга, объясняют, почему при временном нарушении церебрального кровотока, как правило, развиваются транзиторные мозговые явления.
Окисление глюкозы - единственный источник энергии в нервной ткани. Резервы глюкозы и кислорода в мозге ничтожно малы. Поэтому обеспечение ими полностью зависит от интенсивности мозгового кровотока. При полной аноксии "местные" запасы кислорода составляют лишь 7 - 10 мл и достаточны для поддержания функций мозга в течение 10 сек. Затем развивается потеря сознания. Необратимое повреждение клеток мозга развивается в течение 4 - 5 мин полной аноксии. Тем не менее восстановление функций возможно и после 8 минут аноксии при условии хорошей гемоперфузии. Энергообеспечение мозга страдает при разных типах острых интоксикаций, сопровождающихся нарушением внешнего дыхания, мозгового кровотока, кислородотрансапортных функций крови, тканевого дыхания.
1.7. Мозговой кровоток
Кровоток обеспечивает снабжения мозга кислородом и субстратами, необходимыми для поддержания пластического и энергетического обмена, а также удаление из ткани мозга диоксида углерода, образующегося в процессе дыхания, и других метаболитов.
Кровоснабжение мозга - саморегулирующаяся система. Это означает, что в интервале давления церебральной гемоперфузии 6,65 - 20,0 кРа (50 - 150 мм Hg), скорость мозгового кровотока остаётся неизменной. Ниже 50 мм Hg интенсивность кровотока уменьшается пропорционально снижению давления. При этом ухудшается снабжение мозга кислородом и субстратами. Высокое перфузионное давление крови (более 150 мм Hg) нарушает механизм ауторегуляции, повышается гидростатическое давление в капиллярах мозга, при этом нарушается функциональная целостность ГЭБ. Мозговой кровоток тесно связан с интенсивностью метаболических процессов в ЦНС, как полагают, с помощью механизма, регулируемого концентрацией СО2 и ионов водорода, продуцируемых нейронами и клетками глии. Основным фактором регуляции является ион водорода, который непосредственно влияет на тонус мозговых сосудов. Ацидоз способствует расширению сосудов и усилению мозгового кровотока; алкалоз вызывает спазм сосудов и уменьшает интенсивность мозгового кровотока. Таким образом, мозговой кровоток - важнейшая производная кислотно-основного равновесия в мозге. Усиление нейрональной активности сопровождается повышением образования СО2 и ацидозом. Повышение содержания Н+ в межклеточном пространстве мозга вызывает расширение сосудов, усиливает мозговой кровоток, вымывая углекислый газ и восстанавливая нормальное кислотно-основное равновесие. Интоксикации многими веществами сопровождаются глубоким нарушением кислотно-основного равновесия (метанол, этиленгликоль, цианиды и т.д.), что пагубным образом сказывается на состоянии ЦНС отравленных. Ряд токсикантов оказывает нейротоксический эффект, действуя на сосудистое русло мозга, нарушая мозговой кровоток (свинец, кадмий, висмут, клофилин).
1.8. Внутричерепное давление
Внутричерепное давление определяется объёмом цереброспинальной жидкости, протекающей через мозг крови и объёмом самого мозга. В нормальных условиях увеличение одного из указанных объёмов компенсируется уменьшением других.
2. Причины уязвимости нервной системы для токсикантов
Уязвимость нервной системы для повреждающего действия химических веществ обусловлена следующими обстоятельствами:
- многие химические вещества легко проникают через ГЭБ, а также действуют на нервные образования, не защищенные ГЭБ;
- длинные нервные отростки (аксоны и дендриты) значительно увеличивают площадь контакта нейрона с окружающей его средой, увеличивая уязвимость клеток для токсического повреждения;
- для нормального течения физиологических процессов в ЦНС необходимо поддержание электрохимического баланса в элементах нервной системы, обеспечивающееся многочисленными механизмами, на которые могут воздействовать различные химические вещества;
- нервные клетки, как правило, не в состоянии регенерировать и потому их гибель приводит к относительно стойким последствиям;
- токсические повреждения, полученные в раннем возрасте, могут проявляться и усиливаться по мере старения организма, так как потеря нейронов и другие изменения в нервной системе прогрессивно нарастают во второй половине жизни;
- даже незначительные нарушения структуры и функции нервной системы могут иметь пагубные последствия для функционирования организма в целом, проявляющиеся неврологическими, поведенческими расстройствами, изменением функций других органов и систем.
3. Характеристика нейротоксикантов и нейротоксических процессов.
3.1. Нейротоксиканты
Нейротоксиканты, как и другие ксенобиотики попадают в организм ингаляционно, через рот или кожу. Ряд веществ могут действовать несколькими путями.
Важнейшим условием прямого действия нейротоксиканта на ЦНС является его способность проникать через гематоэнцефалический барьер. Вещества, не проникающие через ГЭБ, могут вызывать токсические эффекты на периферии, главным образом в области синаптических контактов нервных волокон с иннервируемыми клетками органов, вегетативных и чувствительных ганглиев.
Отдельные токсичные соединения, не способные преодолевать ГЭБ, тем не менее нашли применение в практике медико-биологического эксперимента для изучения свойств центральной нервной системы. Они проявляют свойства нейротоксикантов только при внутрицеребральном или внутрижелудочковом способе введения (6-гидроксидофамин, 5,6-дигидрокситриптамин и др.).
Некоторые широко используемые промышленные агенты и экополлютанты, обладающие высокой нейротоксичностью, представлены в таблице 3.
Таблица 3. Некоторые промышленные агенты и экополлютанты, обладающие нейротоксичностью
1. Органические растворители: бензол, ксилол, метанол, н-гексан, сероуглерод, метилэтилкетон, перхлорэтилен, стирол, толуол, трихлорэтилен, 1,1,1-трихлорэтан |
3. Пестициды: фосфорорганические соединения, карбаматы, метилртуть, метилбромид, хлорорганические соединения |
2. Металлы и их соединения: алюминий, сурьма, мышьяк, висмут, золото, свинец, литий, марганец, ртуть, селен, таллий, олово, кремний, цинк, триэтилолово, тетраэтилсвинец |
4. Газы: оксид углерода, сероводород, синильная кислота, этиленоксид, метилхлорид 5. Прочие: акриламид, фенол |
Возможно избирательное действие токсикантов на отдельные элементы нервной системы. Так, некоторые вещества повреждают нейроны (причем преимущественно либо тела нервных клеток, либо аксоны, либо синапсы), другие - глиальные элементы. Точки приложения большей части токсикантов не определены. Избирательность токсического действия, носит относительный характер. С увеличением дозы ядов все менее избирательным становится повреждение. Примеры веществ, относительно специфично действующих на отдельные структурные элементы нервной системы, представлены в таблице 4.
Таблица 4. Примеры токсикантов, избирательно действующих на отдельные структурные элементы нервной системы
Тела нервных клеток и дендриты - соединения ртути - марганец - алюминий - глутамат - цианиды - таллий - МФТГ* Аксоны - тетродотоксин - сакситоксин - вератрин - н-гексан - сероуглерод - колхицин - акриламид - перитроиды - триортокрезилфосфат (ТОКФ) |
Синапсы - никотин - фосфорорганические соединения - карбаматы - хинуклединилбензилаты - бициклофосфаты - норборнан - пикртоксинин - диэтиламид лизергиновой кислоты - канабинол - фенамин - ботулотоксин - тетанотоксин Миелиновая оболочка - гексахлорфенол - триэтилолово - теллур |
* - 1метил-4-фенил-1,2,3,6-тетрагидропиридин. Вещество, являясь примесью "синтетического героина", вызывает необратимые поражения мозга, проявляющиеся симптомами паркинсонизма.
Анатомия повреждения мозга также зависит от свойств ядов. На таблице 5 представлены морфологические особенности поражения нервной системы наиболее известными токсикантами.
Таблица 5. Структуры нервной системы, повреждаемые некоторыми токсикантами
Диффузное поражение нейронов ЦНС |
- фосфорорганические соединения - органические растворители (стирол, трихлорэтилен, толуол, 1,1,1-трихлорэтан) - таллий - марганец |
Базальные ганглии |
- СО - метанол - тетраэтилсвинец - триэтилолово |
Фокальный некроз коры головного мозга и мозжечка |
- СО |
Чувствительные нервные волокна периферических нервов |
- металлы (мышьяк, ртуть, таллий) - сероуглерод - гексан - акриламид - метилбутилкетон - этиленоксид - органические растворители |
Двигательные нервные волокна периферических нервов |
- гексахлорофен - металлы (свинец, теллур, таллий, мышьяк, ртуть) - триэтилолово - три-О-крезилфосфат |
Тройничный и лицевой нервы |
- трихлорэтилен |
Вегетативные ганглии и дорзальные корешки спинного мозга |
- ртуть - метилртуть - пиридоксин |
3.2. Нейротоксические процессы
3.2.1. Механизмы действия нейротоксикантов
Развивающаяся патология является следствием воздействия токсикантов на возбудимые мембраны, механизмы передачи нервного импульса в синапсах, пластический и/или энергетический (гипоксия, ишемия) обмен в нервной ткани.
Классификация наиболее известных в настоящее время высокоспецифичных нейротоксикантов, часто используемых в эксперименте для изучения явления нейротоксичности, и механизмы их действия на нервные клетки, представлена на таблице 6.
Таблица 6. Классификация "избирательных" нейротоксикантов в соответствии с механизмами их действия
1. Токсиканты, разрушающие определенные нервные клетки ЦНС - 6-гидроксидофамин: дофаминергические нейроны - 5,6-дигидрокситриптамин: серотонинергические нейроны - капсаицин: нейроны, синтезирующие субстанцию Р - 3-ацетилпиридин: нейроны олив мозга |
2. Токсиканты, действующие на специфические рецепторы: А. Антагонисты: - курарин, 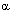 -бунгаротоксин, эрабутоксин: Н-холинорецепторы
-бунгаротоксин, эрабутоксин: Н-холинорецепторы- атропин, скополамин, хинуклединилбензилат: М-холинорецепторы - ДЛК, псилоцибин: серотонинергические рецепторы - бициклофосфаты, норборнан, пикротоксин, бикукуллин: ГАМК-рецепторы - стрихнин: глициновые рецепторы Б. Агонисты: - никотин, анабазин: Н-холинорецепторы - ФОС, карбаматы: М- и Н-холинорецепторы - каиновая кислота и её аналоги: рецепторы глютамата |
3. Токсиканты, действующие на пресинаптические структуры: - ботулотоксин, кротоксин: Н-холинергические синапсы - резерпин: катехоламинергические синапсы |
4. Токсиканты, действующие на натриевые каналы: А. Блокаторы проницаемости: - тетродотоксин - сакситоксин Б. Активаторы проницаемости: - аконитин - вератридин - батрахотоксин - токсины скорпионов |
5. Токсины, действующие на калиевые каналы: А. Блокаторы проницаемости: - аминопиридин - новокаин и его аналоги Б. Активаторы проницаемости: - тетраэтиламмоний - пентилентетразол |
6. Токсиканты, нарушающие биоэнергетику мозга: - цианиды, сульфиды - фторуксусная кислота - динитрофенол |
7. Токсиканты, угнетающие аксональный транспорт: - колхицин - цитохалазин |
8. Токсиканты, блокирующие митозы - метилазоксиметанол-гликозид (циказин) |
Как видно из таблицы, в основе токсичности большинства известных нейротоксикантов лежит способность действовать на возбудимые мембраны и механизмы передачи нервного импульса в синапсах. Однако, последствия нарушений энергетического и пластического обмена для нервной системы также весьма пагубны.
Дефицит энергообеспечения может быть следствием первичного поражения клеток нервной системы (интоксикация цианидами, производными фторкарбоновых кислот и др.) и действия токсикантов на гемодинамику, кислородтранспортные функции крови, внешнее дыхание. В наибольшей степени нарушение энергетического обмена сказывается на состоянии нейронов, в которых высок уровень процессов потребления кислорода и синтеза макроэргов. В целом клетки малого размера с большим количеством дендритов более чувствительны к гипоксии (ишемии), чем большие нейроны с длинными аксонами и малым количеством дендритов (мотонейроны). Глиальные и эндотелиальные клетки менее чувствительны к гипоксии (ишемии) и по этому показателю распределяются следующим образом: олигодендроглия > астроциты > микроглия > эндотелий капилляров > белое вещество мозга. Среди структур, образуемых серым веществом, наиболее чувствительными к гипоксии являются: кора головного мозга (малые гранулярные клетки - 4 слой), кора мозжечка (клетки Пуркинье), гиппокамп (клетки полей Н1 и Н2).
В настоящее время интимные механизмы нейротоксичности большинства токсикантов неизвестны.
4. Проявления нейротоксических процессов
Нейротоксический процесс проявляется в форме нарушений моторных, сенсорных функций, эмоционального статуса, интегративных функций мозга, таких как память, обучение. Часто нарушается зрение, слух, тактильная и болевая чувствительность и т.д. Сенсомоторные нарушения приводят к появлению мышечной слабости, парезов и параличей. Повреждение механизмов регуляции функций жизненно важных органов и систем (дыхательной, сердечно-сосудистой) порой заканчивается гибелью отравленных. В ряде случаев, основными проявлениями токсического процесса могут стать изменение поведения пострадавших или экспериментальных животных.
Последствия действия химических веществ на нервную систему представлены в таблице 7.
Таблица 7. Некоторые проявления нейротоксического действия ксенобиотиков
Общие эффекты - утомление - потеря аппетита - ступор - наркоз - кома Двигательные нарушения - слабость - тремор - подергивания отдельных групп мышц - нарушение координации движений - нарушение рефлексов - параличи - судороги Сенсорные нарушения - ощущение раздражения глаз, слизистых, кожи - парестезии - тактильные нарушения - болевой синдром - нарушения зрения - нарушения слуха |
Нарушение когнитивных функций - нарушение памяти - нарушение речи - нарушение обучения Нарушения сознания и эмоций - нарушения сна - раздражительность - беспокойство - депрессия - спутанность сознания - напряженность - иллюзии - галлюцинации - бред |
В зависимости от условий действия, строения токсиканта, его нейротоксического потенциала развивающиеся процессы протекают остро или хронически.
Острые нейротоксические процессы обычно обусловлены нарушениями физиологических или биохимических механизмов в нервной системе и не связаны с дегенеративными изменениями нейроцеллюлярных элементов. Подобные эффекты обычно формируются после однократного воздействия токсиканта в относительно высокой дозе и носят обратимый характер. Как правило таким образом развивается интоксикация веществами, нарушающими передачу нервного импульса в синапсах (многочисленные синаптические яды), проведение возбуждения по возбудимым мембранам (вератрин, тетродотоксин, сакситоксин, этанол, хлороформ и др.), и некоторыми веществами, нарушающими энергетический обмен в мозге (синильная кислота, динитрофенол и др).
Острые нейротоксические процессы в ЦНС проявляются либо гиперактивацией нервных структур (возбуждение, судорожный синдром), либо их угнетением (заторможенность, оглушонность, утрата сознания), либо дезорганизацией высшей нервной деятельности с развитием транзиторного психодислептического состояния (неадекватные эмоции, иллюзии, галлюцинации, бред и т.д.). При острой интоксикации любым центральным нейротоксикантом, в зависимости от действующей дозы, можно наблюдать отдельные признаки каждого из упомянутых эффектов. Однако значительное преобладание в токсическом действии возбуждающего, тормозного или психодислептического элементов, позволяет условно относить вещества, соответственно, к судорожным, седативно-гипнотическим и психодислептическим агентам.
Проявления острого нейротоксического действия на периферии - это, как правило, следствие нарушений проведения нервных импульсов по двигательным, вегетативным волокнам и блокада или извращение, поступающей сенсорной информации (онемения конечностей, парестезии, боль).
Хронически протекающие нейротоксические процессы обусловлены длительным или, реже, однократным действием токсикантов, преимущественно нарушающих пластический (свинец, тетраэтилсвинец, триметилолово, таллий, ртуть, ТОКФ и др.) или энергетический (оксид углерода) обмен. Их развитие часто сопряжено с альтерацией структурных элементов нервной системы: нейронов, их дендритов и аксонов, миелина, миелинобразующих клеток, эндотелиальных клеток.
Центральные хронические нейротоксические процессы, как правило, мало специфичны. Однако при интоксикациях некоторыми веществами (тетраэтилсвинец) периоду развития хронических эффектов предшествует достаточно специфичная клиника острого нарушения функций мозга.
Периферические нейротоксические эффекты проявляются стойкими нейропатиями. Вследствие того, что репаративные возможности нервной системы относительно малы, даже острые интоксикации могут сопровождаться развитием вялых, длительно текущих расстройств. Так, отравления некоторыми ФОС нередко приводит к формированию стойкой полиневропатии. По существующим данным (Salem E.L., El-Ghaweby S.H., 1980), широкое использование лептофоса для уничтожения вредителей хлопка в Египте привело к развитию тяжелых нейропатий у более чем 3000 человек, причем 30 человек погибло.
Один и тот же токсикант, действуя в разных дозах, может вызывать различные патологические реакции. Так, гексан при остром воздействии в высоких дозах вызывает состояние оглушенности, наркоз, кому (то есть формируется острый токсический процесс), а при длительной экспозиции в относительно малых дозах приводит к формированию стойкой дистальной аксонопатии (хронический токсический процесс).
Основные нарушения со стороны нервной системы, складывающиеся при интоксикациях, представлены на таблицах 8 и 9.
Таблица 8. Центральные нейротоксические эффекты
Острые эффекты |
Хронические эффекты |
- головокружение - эйфория - возбуждение - галлюцинации - бред - психомоторное возбуждение - нарушение походки - нарушение координации движений - судороги - сопор - кома |
- нарушение настроения - депрессия - раздражительность - нарушение сна - нарушение внимания - нарушение памяти - изменение личности - паркинсонизм -экстрапирамидные и мозжечковые знаки |
Таблица 9. Периферические нейротоксические эффекты
Острые эффекты |
Хронические эффекты |
- раздражение покровных тканей; - онемение конечностей; - парестезии; - нарушение тонуса мышц (до полного паралича); - нарушение тонуса гладкой мускулатуры; - нарушение функций экзокринных желез; - нарушение сердечной деятельности и дыхания |
- периферические нейропатии, развивающиеся в проксимальном направлении; - нейропатии, сопровождающиеся поведенческими нарушениями; - полиневропатия с вовлечением дистальных отделов нервов; - мультифокальные патологические изменения; - периферическая денервация |
Далеко не всегда нейротоксическое действие веществ легко выявить. Судороги, галлюцинации, потеря памяти и др. диагностируются просто. Однако большинство проявлений токсического процесса могут быть выявлены только специалистами невропатологами или психиатрами. Такие явления, как сонливость, умеренные головные боли, легкая бессонница, могут длительное время не предъявляться отравленным в качестве жалоб.
4.1. Острые нейротоксические процессы
4.1.1. Судорожный синдром. Конвульсанты
Известно огромное количество веществ, как синтетических, так и естественного происхождения, способных провоцировать развитие судорожного синдрома у человека и экспериментальных животных. Многие из этих веществ не относятся к избирательным нейротоксикантам и вызывают судороги, действуя в относительно высоких дозах. Действие других, напротив, чрезвычайно селективно и проявляется при попадании в организм в ничтожных количествах. Такие вещества называют конвульсантами или судорожными агентами. Их изучение представляет особый интерес, поскольку позволяет вскрывать механизмы, лежащие в основе данной формы нейротоксического процесса, разрабатывать эффективные противосудорожные препараты.
Механизмы, посредством которых токсиканты вызывают судороги, могут быть классифицированы на несколько логических категорий, исходя из представлений, согласно которым нормальное функциональное состояние ЦНС является следствием баланса между процессами возбуждения и торможения нейрональных систем. Судороги возникают либо в результате гиперактивации процессов возбуждения, либо угнетения процессов торможения (таблица 10).
Таблица 10. Возможные общие механизмы генерации судорожного синдрома
Активация процессов возбуждения |
Угнетение процессов торможения |
- прямая активация возбудимых мембран нервных клеток; - активация постсинаптических рецепторов возбуждающих нейромедиаторов; - увеличение количества возбуждающего нейромедиатора, высвобождающегося в синаптическую щель при прохождении нервного импульса; - пролонгация действия возбуждающего нейромедиатора в следствие угнетения механизмов разрушения или реаптейка; - повышение чувствительности постсинаптических рецепторов к возбуждающему нейромедиатору; - снижение потенциала покоя постсинаптических мембран клеток; |
- блокада постсинаптических рецепторов тормозных нейромедиаторов; - уменьшение количества тормозного нейромедиатора, высвобождающегося в синаптическую щель при прохождении нервного импульса; - блок высвобождения тормозного нейромедиатора; - понижение чувствительности постсинаптических рецепторов к тормозному нейромедиатору; - сокращение продолжительности действия тормозного нейромедиатора в результате активации механизмов разрушения и реаптейка |
Тормозные процессы в ЦНС осуществляются с помощью пресинаптических и постсинаптических механизмов. В обоих механизмах участвуют специфические нейромедиаторные системы мозга. В спинном и продолговатом мозге постсинаптическое торможение осуществляется с участием глицина. В высших отделах ЦНС механизмы пре- и постсинаптического торможения опосредованы высвобождением в синаптическую щель
 -аминомасляной кислоты (ГАМК).
-аминомасляной кислоты (ГАМК).Основными возбуждающими нейромедиаторами мозга являются ацетилхолин и возбуждающие аминокислоты (глутамат, аспартат).
Острое нарушение энергообмена в организме (тяжелое отравление цианидами, сульфидами, фторуксусной кислотой и т.д.) может сопровождаться развитием судорог.
Предполагаемые механизмы действия конвульсантов представлены в таблице 11.
Таблица 11. Предполагаемые механизмы действия некоторых конвульсантов
Механизмы действия |
Вещества |
1. Активация возбуждающих систем мозга: -прямое действие на возбудимые мембраны, изменение ионной проводимости; -селективный постсинаптический антагонизм с ГАМК -угнетение активности холинэстеразы и накопление ацетилхолина в синаптической щели -открытие Na+ каналов в результате прямого действия на возбудимые мембраны -стимуляция рецепторов возбуждающих аминокислот (глютамата, аспартата) -усиление проницаемости возбудимых мембран для Na+ путем вытеснения Са2+ с поверхности возбудимых мембран 2. Блокада тормозных систем мозга А. Угнетение ГАМК-рецепторов: -постсинаптический антагонизм с ГАМК путем действия на ГАМК-рецепторы -постсинаптический антагонизм с ГАМК в результате действия на барбитуровые рецепторы -усиление инфлюкса Ca2+ в нервные терминалии и активация выброса возбуждающих нейромедиаторов Б. Угнетение синтеза ГАМК или её высвобождения: -блокада высвобождения ГАМК из нервных окончаний -угнетение активности декарбоксилазы глютаминовой кислоты (ДГК), глютамилцистеинсинтетазы и цистатионазы -угнетение активности ДГК -усиление активности ГАМК-трансаминазы -нарушение метаболизма ГАМК в следствие угнетения активности пиридоксалькиназы В. Действие на глицинергические рецеапторы: -действие на глицин-зависимый ионофорный комплекс и нарушение проницаемости возбудимых мембран для Cl- 3. Нарушение энергетического обмена в мозге и в следствие этого механизмов ионного транспорта 4. Нарушение механизмов ионного транспорта: -угнетение активности Na+-K+-АТФазы |
пентилентетразол и его аналоги антихолинэстеразные вещества фторэтил* каиновая кислота, иботеновая кислота, N-метил-D-аспартат пикротоксин, бикукуллин, бициклофосфаты, норборнан судорожные барбитураты** тетанотоксин аллилглицин 3-меркаптопропионовая кислота гидразин, тиосемикарбазид и др. стрихнин, бруцин фторацетат, цианиды, сулфиды, динитрофенол и т.д. оуабаин |
* - гексафтордиэтиловый эфир
** - диметилбутил-этил барбитуровая кислота и др.
Для устранения судорожного синдрома, вызванного токсикантами, помимо этиотропных препаратов (там, где они существуют) рекомендуют вводить средства патогенетической терапии. Среди наиболее употребимых:
1. Диазепам - 0,3 мг/кг, в/м;
2. Гексенал, тиопентал - до 20 мг/кг, в/в;
3. Оксибутират натрия - до 150 мг/кг, в/в, медленно;
4. Дифенин - 15 - 20 мг/кг, в/в;
5. Магния сульфат - 50 мг/кг, 6 % раствор, в/в
6. Миорелаксанты, искусственная вентиляция легких.
4.1.1.1. Конвульсанты, активирующие возбуждающие процессы в ЦНС
К числу веществ, вызывающих судороги путем активации возбуждающих систем мозга, относятся соединения, непосредственно действующие на возбудимые мембраны нейронов, либо иными способами усиливающие проведение нервных импульсов в холинергических и глутаматергических синапсах (см. таблицу). Структура некоторых таких токсикантов показана на рисунке 1.
Рисунок 1. Структура некоторых конвульсантов
Пентилентетразол (ПТЗ) является представителем группы тетразолиевых конвудьсантов, непосредственно действующих на возбудимые мембраны нейронов ЦНС. Зарин, представитель огромного класса фосфорорганических соединений (ФОС), и физостигмин из группы карбаматов, являются ингибиторами холинэстеразы, возбуждающими холинэргические структуры мозга. Наконец, каиновая кислота - агент, действующий на центральные рецепторы возбуждающих аминокислот (глутамата).
4.1.1.1.1. Вещества, действующие на возбудимые мембраны и нарушающие механизмы ионного транспорта
Пентилентетразол (метразол)
В серии производных тетразола от триметилентетразола до гептаметилентетразола, судорожная активность возрастает с увеличением числа метиленовых групп в молекуле (таблица 12). Высказывается предположение, что их активность определяется способностью растворяться в липидах: чем выше коэффициент распределения масло/вода, тем активнее агент. Пентилентетразол (ПТЗ) широко используется в экспериментальной медицине для моделирования судорожного синдрома, при скрининге новых антиконвульсантов.
Таблица 12. Дозы производных тетразола, вызывающие судорожный синдром у мышей при внутрибрюшинном способе введения
Название |
Эффективная доза (мг/кг) |
Триметилентетразол Тетраметилентетразол Пентаметилентетразол (ПТЗ) Гексаметилентетразол Гептаметилентетразол |
900 250 50 40 30 |
Вещество легко абсорбируется из мест введения и быстро распределяется в организме, преимущественно в водной фазе. С протеинами плазмы крови связывается менее 9% введенного соединения. ПТЗ подвергается метаболическим превращениям под влиянием микросомальных энзимов. Менее 5% введенного соединения выводится в неизменной форме. Основной путь выведения - через почки. Период полуэлиминации из плазмы крови крысы составляет от 2,5 до 6 часов.
Действуя в предсудорожных дозах, вещество вызывает усиление двигательной активности. Сенсорная стимуляция (свет, звук, прикосновение), на этом фоне, не приводит к развитию приступа судорог, как это имеет место при отравлении стрихнином. Более высокие дозы вещества вызывают генерализованные клонико-тонические судороги.
Механизм действия ПТЗ до конца не выяснен. Установлено, что токсикант обладает прямым действием на возбудимые мембраны. Эти данные получены в опытах с изолированными нейронами, в условиях, при которых синаптические влияния исключены. ПТЗ в концентрациях от 10 до 70 мМ вызывает медленно-волновую осциляцию мембранного потенциала и разряды импульсов. Полагают, что в основе эффекта лежит способность увеличивать проницаемость возбудимых мембран для ионов хлора и калия и вызывать тем самым их деполяризацию. Имеются противоречивые данные о способности вещества угнетать активность Na+-K+-АТФазы.
Другим важным механизмом действия ПТЗ является его способность избирательно блокировать постсинаптическое торможение нейронов ЦНС млекопитающих, опосредованное ГАМК.
Оуабаин
Классическими представителями этой группы веществ являются гликозиды дигиталиса и, в частности, оуабаин (G-строфантин). Молекулы всех гликозидов этой группы представляют собой комплекс агликона (генина) с одной или несколькими молекулами сахаров (гликоны). Фармакологическую и токсикологическую активность веществ определяет структура агликона. Однако токсикокинетические характеристики веществ, в частности способность проникать через биологические барьеры, зависит от гликона.
Оуабаин содержит в молекуле один остаток рамнозы, присоединенный к С-3 углеродному атому полициклической структуры, стероидной природы (рисунок 2). Вещество выделяют из семян растения Strophanus gratus.
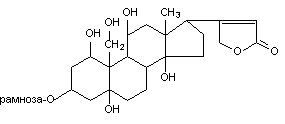
Рисунок 2. Структура молекулы оуабаина
Оуабаин всасывается в желудочно-кишечном тракте. Его действие начинается спустя 5 - 10 минут после приема. Максимальная активность проявляется через 30 минут и продолжается в течение полутора часов. Период полувыведения у человека составляет 21 час. Выделение в основном осуществляется через почки. У взрослых вещество очень плохо проникает через гематоэнцефалический барьер. Отчетливое центральное действие препарата выявляется только при внутрижелудочковом способе введения. Максимальная концентрация при этом определяется в гиппокампе и гипоталамусе. Полагают, что проникновение гликозида внутрь нервной клетки осуществляется с помощью натрий-калий АТФ-азы по механизму аналогичному для транспорта калия. in vitro увеличение содержания калия в инкубационной среде блокирует поступление оуабаина внутрь клетки.
Из-за плохой проницаемости ГЭБ для оуабаина его действие на ЦНС при системном введении выражено слабо. В эксперименте у взрослых крыс судорожный эффект не развивается даже при действии в дозах близких к ЛД50 (70 мг/кг). Судороги вызывают путем введения вещества в ткань или внутрь желудочков мозга. У крысят в возрасте 3 - 9 дней, когда ГЭБ не сформирован, среднеэффективная судорожная доза составляет около 2 мг/кг.
В основе судорожного действия вещества (как и других гликозидов группы дигиталиса) лежит способность нарушать активность Na+-K+-АТФазы, что приводит к снижению содержания калия и увеличению натрия внутри нейронов, деполяризации их мембран, гиперактивации нервных клеток и судорогам.
Таким образом, гликозиды нельзя отнести в полной мере к группе конвульсантов, но на их основе, при модификации молекулы, обеспечивающей проникновение веществ в мозг через ГЭБ, могут появиться вещества с высокой судорожной активностью.
Средства специфической терапии отсутствуют.
Фторэтил (гексафтордиэтиловый эфир)
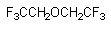
Фторэтил - летучее вещество, родственное современным фторсодержащим общим анестетикам, вызывающее у лабораторных животных приступы тяжелых клонико-тонических судорог, как при вдыхании, так и при системном введении в организм (Krantz et.al, 1957). Вещество быстро выделяется из организма через легкие и поэтому действие его кратковременно.
Будучи чрезвычайно близким, по строению и свойствам, фторсодержащим ингаляционным анестетикам (см. ниже), фторэтил обладает совершенно иной физиологической активностью. Его изомер - гексафторизопропил - (CF3)2CHOCH3, практически не обладает свойствами конвульсанта. Полагают, что в основе действия токсиканта лежит способность активировать инфлюкс натрия через возбудимые мембраны, вызывая тем самым активацию нейронов. Не исключено, что в процессе метаболизма фторэтила образуется трифторацетат - вещество близкое по строению фторацетату. Как известно (см. ниже), целый ряд фторкарбоновых кислот, эфиров фторкарбоновых кислот, фторированных спиртов, способных метаболизировать в организме с образованием фторуксусной кислоты, проявляют свойства конвульсантов.
Фенобарбитал, диазепам, этосуксимид - устраняют судорожный синдром, вызываемый фторэтилом.
4.1.1.1.2. Вещества, активирующие холинэргические структуры мозга
Синаптические структуры, в которых медиаторную функцию выполняет ацетилхолин, обнаружены как в центральной нервной системе, так и на периферии (автономный и соматический отделы). Общепринято, что нейромедитор и в ЦНС и ПНС взаимодействует с двумя видами рецепторов: мускариновыми и никотиновыми, отличающимися между собой способностью отвечать на воздействие ряда агонистов (М-холинорецепторы избирательно возбуждаются мускарином; Н-холинорецепторы - никотином), механизмом рецепции сигнала и его передачи на эффекторную клетку (нейрон, миоцит, железистую клетку). Н-холинорецептор является прямым регулятором состояния ионных каналов постсинаптической мембраны для Na+, K+, Ca2+. М-холинорецепторы (в настоящее время выделяют несколько подтипов) представляют собой рецепторы связанные с G-протеинами (см. раздел "Механизмы токсического действия"). Установлено, что в некоторых мускарин-чувствительных холинергических синапсах Н-холинорецепторы обнаруживаются на пресинаптической мембране, т.е. выполняют роль регуляторов их активности.
Процесс передачи сигнала в холинэргических синапсах может быть представлен несколькими этапами:
- синтез медиатора из холина и ацетата при участии энзима холин-ацетил трансферазы (ХАТ) и его депонирование в пресинаптических везикулах;
- выделение ацетилхолина в синаптическую щель (спонтанно и при поступлении в нервное окончание возбуждающего сигнала);
- взаимодействие ацетилхолина с холинорецепторами постсинаптической (и, по некоторым данным, пресинаптической) мембраны и инициация стимула в иннервируемой клетке;
- разрушение выделившегося в синаптическую щель нейромедиатора энзимом ацетилхолинэстеразой (АХЭ) и прекращение процесса передачи сигнала;
- захват пресинаптическими структурами высвободившегося холина.
Наиболее уязвимыми для действия высокотоксичных веществ являются этапы выделения ацетилхолина в синаптическую щель, взаимодействия с холинорецепторами и разрушения АХЭ (рисунок 3).
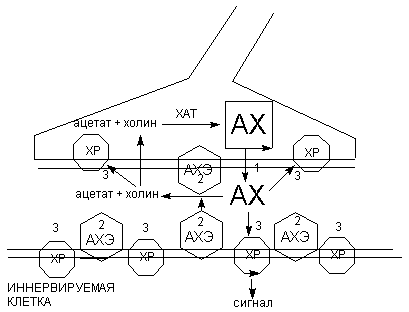
Рисунок 3. Схема функционирования холинэргического синапса.
1 - 3 - механизмы действия токсикантов:
1 - ботулотоксин
2 - ингибиторы АХЭ
3 - холинэргические и антихолинэргические средства
В ЦНС плотность М-холинорецепторв существенно выше, чем Н-холинорецепторов. Наивысшая плотность холинэргических нервных окончаний определяется в хвостатом, прилежащем, чичевичном ядрах, гиппокампе, гипоталамусе, коре головного мозга, мозжечке.
Перевозбуждение центральных холинэргических механизмов может приводить к развитию судорожного синдрома. Наибольшей активностью в этом плане обладают ингибиторы АХЭ, способные проникать через гематоэнцефалический барьер (ФОС, карбаматы).
Фосфорорганические соединения
Все соединения фосфорной и фосфоновой кислот, обозначаемые как фосфорорганические соединения (ФОС), имеют структуру:
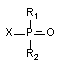
R1 и R2 - алкил-, алкокси-, диалкиламидные и др. группы; Х - кислотный остаток, в качестве которого могут выступать фтор-, циан-, ацильный- и другие радикалы.
Фосфорорганические соединения нашли применение как инсектициды (хлорофос, карбофос, фосдрин, лептофос и др.) и лекарственные препараты (фосфакол, армин и т.д.). Наиболее токсичные представители группы были приняты на вооружение армий целого ряда стран в качестве боевых отравляющих веществ (зарин, зоман, табун, Vx).
ФОС хорошо растворяются в липидах и, вследствие этого, легко проникают через гематоэнцефалический барьер и оказывают непосредственное действие на холинэргические синапсы мозга. ФОС являются ингибиторами АХЭ, практически необратимо взаимодействующими с ее активным центром (фосфорилирование энзима). В результате их действия угнетается процесс разрушения АХ в синапсах. Медиатор накапливается в синаптической щели и вызывает гиперактивацию постсинаптических холинэргических рецепторов (непрямое холиномиметическое действие). Легкое поражение ФОС, как правило, развивается при угнетении АХЭ более, чем на 50%, средней степени тяжести - более 70%, тяжелой - около 90%. Кроме того, будучи в известной степени структурными аналогами ацетилхолина, вещества оказывают прямое возбуждающее действие на холинорецепторы. Гиперактивация холинорецепторов приводит к перевозбуждению холинэргических механизмов мозга, что, при достаточной степени поражения, приводит к развитию судорожного синдрома.
Восстановление нормального проведения нервного импульса осуществляется за счет медленно протекающих процессов дэфосфорилирования АХЭ (спонтанная реактивация энзима), синтеза АХЭ de novo, десенситизации холинорецепторов.
Элиминация ядов из организма проходит с разной скоростью. Некоторые вещества способны к относительно продолжительному персистированию (карбофос - сутки и более). Наиболее токсичные представители очень быстро разрушаются при участии гидролаз и оксидаз смешанной функции и уже спустя час после внутрибрюшинного введения экспериментальным животным в крови определяются в следовых количествах. Значительная часть ФОС связывается эстеразами плазмы крови и не оказывает действия на холинэргические синапсы ЦНС и ПНС.
Симптомы интоксикации ФОС при ингаляционном поражении развиваются практически немедленно, при поступлении через рот или кожу - через десятки минут. При действии в несудорожных дозах вещества вызывают возбуждение, бессонницу, головные боли, галлюцинации, чувство страха, апатию, депрессию, тремор. Интоксикация всегда сопровождается нарушениями со стороны жизненно важных органов и систем: дыхательной, сердечно-сосудистой, желудочно-кишечного тракта (активация парасимпатического отдела вегетативной нервной системы). При тяжелых поражениях судорожный синдром протекает на фоне полной утраты сознания и если не заканчивается летальным исходом (от остановки дыхания) приводит к коме. Продолжительность острой фазы интоксикации от нескольких часов до суток.
Специфическими противоядиями ФОС являются реактиваторы холинэстеразы (дипироксим, пралидоксим, токсогонин и др.) и холинолитики (М- и Н- , центральные и периферические). Наиболее часто используемый в клинической практике препарат - атропин, вводимый в дозах, существенно превосходящих максимальную суточную, рекомендуемую фармакопеей (десятки миллиграмм в сутки). В качестве средств борьбы с судорогами рекомендуют назначение производных бензодиазепина (диазепам).
Карбаматы
Производные карбаминовой кислоты - карбаматы (рисунок 4) давно известны, как активные ингибиторы холинэстеразы (ХЭ).
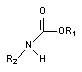
Рисунок 4. Структурная формула карбаматов
Некоторые представители группы, прежде всего растительного происхождения (физостигмин, галантамин), обладают высокой токсичностью, но в силу избирательности действия широко используются в качестве лекарственных препаратов. Многие синтетические аналоги, обладающие меньшей токсичностью для млекопитающих, но высокотоксичные для насекомых, применяются в качестве инсектицидов. Среди них: пропоксур (ЛД50 - 90 - 124 мг/кг), изопрокарб (ЛД50 - 400 - 485 мг/кг), диоксакарб (ЛД50 - 60 - 80 мг/кг), бендиокарб (ЛД50 - 60 мг/кг). В настоящее время известны и весьма токсичные для человека синтетические производные карбаминовой кислоты. Нпример, аминостигмин, альдикарб (ЛД50 - 1 мг/кг), бис-(диметилкарбамокси-бензил)-алкан-диметил-галид (ЛД50 - 0,005 мг/кг). Токсичность соединений определяется строением радикала (R1) при кислородном атоме карбоксильной группы кислоты (рисунок 5).
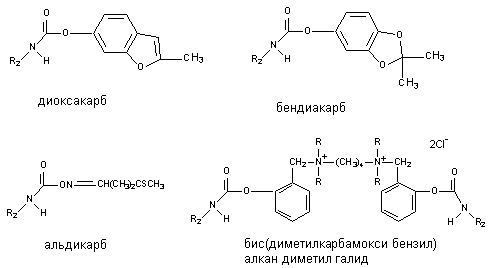
Рисунок 5. Структура некоторых производных карбаминовой кислоты (карбаматов)
Липофильные незаряженные молекулы легко проникают через гематоэнцефалический барьер и оказывают непосредственное действие на холинэргические синапсы. Соединения, содержащие в молекуле четвертичный (заряженный) атом азота, действуют в основном на ПНС (вегетативный и двигательный отделы). Поражение карбаматами (по механизму действия, патогенезу токсического процесса и проявлениям) чрезвычайно напоминает поражение ФОС. Основным проявлением тяжелого поражения карбаматами является судорожный синдром. Особенностью действия карбаматов, в сравнении с ФОС, является обратимый характер ингибирования АХЭ (карбамилирование энзима). В этой связи процесс восстановления нормального проведения нервного импульса в холинергических синапсах осуществляется, в основном, за счет быстрого, в течение нескольких часов, декарбамилирования АХЭ (спонтанной реактивации).
Холинолитики, как и в случае ФОС, являются специфическими противоядиями карбаматов.
Интересно отметить, что профилактическое введение веществ этой группы обеспечивает существенную защиту экспериментальных животных от высокотоксичных ФОС. Наибольшей активностью обладают третичные (проникающие через ГЭБ) карбаматы (физостигмин, галантамин, аминостигмин и др). Защитный механизм объясняют экранированием АХЭ и ХР от действия ФОС как самим карбаматом, так и АХ, накапливающимся в синаптической щели вследствие угнетения некоторой части холинэстеразы, а также развивающейся десенситизацией ХР. Добавление к профилактически вводимому обратимому ингибитору АХЭ холинолитических препаратов еще более усиливает степень защищенности экспериментальных животных.
4.1.1.1.3. Вещества, активирующие глютаматэргические структуры мозга
Глютамат представляет собой аминокислоту, в высокой концентрации содержащуюся в структурах центральной нервной системы. Она образуется путем аминирования
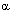 -кетоглютаровой кислоты. Декарбоксилирование глютаминовой кислоты под влиянием фермента декарбоксилазы (ДГК) приводит к образованию ГАМК. Действуя в малых количествах, глютамат возбуждает нейроны спинного мозга, коры головного мозга, мозжечка и других структур ЦНС млекопитающих. Установлено, что вещество является нейромедиатором, выделяющимся в специальных синаптических структурах и взаимодействующим с глютамат-чувствительными рецепторами постсинаптических мембран.
-кетоглютаровой кислоты. Декарбоксилирование глютаминовой кислоты под влиянием фермента декарбоксилазы (ДГК) приводит к образованию ГАМК. Действуя в малых количествах, глютамат возбуждает нейроны спинного мозга, коры головного мозга, мозжечка и других структур ЦНС млекопитающих. Установлено, что вещество является нейромедиатором, выделяющимся в специальных синаптических структурах и взаимодействующим с глютамат-чувствительными рецепторами постсинаптических мембран.Основными глютаматергическими нейрональными трактами ЦНС являются: кортико-стриатный, энторинал-гипокампальный; первичные слуховые волокна кохлеарного ядра, боковой обонятельный, ретино-тектальный, зрительный кортико-тектальный, зрительный кортико-геникулярный, кортико-таламический и др. (McGeer, McGeer, 1980).
Деполяризация постсинаптической мембраны, развивающаяся после действия глютамата на рецепторы, связана с увеличением её проницаемости для ионов натрия. Глютаматергические рецепторы активируются также такими веществами как аспарагиновая кислота, N-метил-D-аспарагиновая кислота (NMDA),
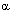 -амино-3-гидрокси-5-метил-4-изоаозолпропионовая кислота (АМПК) и др. Эти возбуждающие аминокислоты не способны проникать через гематоэнцефалический барьер, но вызывают судорожный синдром при их внутрицеребральном введении экспериментальным животным. По способности вызывать судороги аналоги глютамата могут быть ранжированы следующим образом: NMDA (0,5 мМ/кг) >
иботеновая кислота (1,0 мМ/кг), D,L-гомоцистеиновая кислота >
N-метил-L-аспартат (>
1 мМ/кг) >
L-глютамат (20 мМ/кг) >
D-глютамат >
L-аспартат. Неодинаковая чувствительность глютаматергических рецепторов разных структур мозга к агонистам, позволила выделить несколько подтипов этих рецепторов: NMDA-чувствительный, каинатный, квисквалатный, метаботрофный рецепторы.
-амино-3-гидрокси-5-метил-4-изоаозолпропионовая кислота (АМПК) и др. Эти возбуждающие аминокислоты не способны проникать через гематоэнцефалический барьер, но вызывают судорожный синдром при их внутрицеребральном введении экспериментальным животным. По способности вызывать судороги аналоги глютамата могут быть ранжированы следующим образом: NMDA (0,5 мМ/кг) >
иботеновая кислота (1,0 мМ/кг), D,L-гомоцистеиновая кислота >
N-метил-L-аспартат (>
1 мМ/кг) >
L-глютамат (20 мМ/кг) >
D-глютамат >
L-аспартат. Неодинаковая чувствительность глютаматергических рецепторов разных структур мозга к агонистам, позволила выделить несколько подтипов этих рецепторов: NMDA-чувствительный, каинатный, квисквалатный, метаботрофный рецепторы.Токсические проявления системного действия глютамата в больших дозах у млекопитающих - это судороги (крысы, кошки) и рвота (собаки, обезьяны). У людей картину отравления глютаматом называют "синдром китайского ресторана" (поскольку в этих заведениях подают пищу богатую глютаматом), она характеризуется болями и ощущением жжения в верхней половине тела, возбуждением.
Веществом, широко использующимся в эксперименте в качестве судорожного агента, является каиновая кислота.
Каиновая кислота - одна из целой серии аминокислот, выделенных из растений, грибов, водорослей японским химиком Takemoto (1978). Многие из этих аминокислот структурно напоминают глютамат и обладают возбуждающими свойствами. Каиновая кислота является наиболее активным агентом. Судорожный синдром в эксперименте вызывают внутрицеребральным введением каината, поскольку вещество плохо проникает через ГЭБ. Богатым природным источником каиновой кислоты являются морские водоросли Digenea simplex.
Интересной особенностью действия агонистов возбуждающих аминокислот является их способность вызывать гибель нейронов мозга, активирующихся глютаматом, через механизм гиперактивации глютаматергических рецепторов. Это свойство получило название эксайтотоксическое действие (exceitotoxic action). В основе эффекта, как полагают, лежит нарушение гомеостаза внутриклеточного кальция в перевозбужденных нейронах.
В настоящее время синтезировано большое количество антагонистов глютамата, как неконкурентных (кетамин, фенциклидин, МК-801 - дозицилпин и др.), так и конкурентных (кинуренат, 2-амино-5-фосфоновалериановая кислота, 2-амино-7-фосфоногептаноевая кислота и др.), обладающих противосудорожной активностью.
4.1.1.2. Конвульсанты, блокирующие тормозные процессы в ЦНС
Многие конвульсанты, блокируют проведение нервного импульса в синапсах, участвующих в осуществлении механизмов пресинаптического и постсинаптического торможения в ЦНС. К числу таковых, прежде всего, относятся ГАМК-ергические и глицинергические синапсы. В этой связи и токсиканты разделяются на две группы:
- нарушающие проведение импульса в ГАМК-ергических синапсах;
- нарушающие проведение нервного импульса в глицинергичесих синапсах. ГАМК-ергические синапсы вовлечены в механизмы как пре-, так и постсинаптического торможения, глицинергические - только постсинаптического.
4.1.1.2.1. Конвульсанты, действующие на ГАМК-ергический синапс.
Существуют многочисленные данные, подтверждающие участие ГАМК в механизмах пресинаптического и, резистентного к глицину, постсинаптического торможения. ГАМК - нейромедиатор в тормозных синапсах, как позвоночных, так и беспозвоночных животных. ГАМК вызывает гиперполяризацию возбудимой мембраны, что сопровождается формированием ингибиторного пстсинаптического потенциала (ИПСП). Установлено, что в основе этого действия лежит усиление проницаемости возбудимых мембран для ионов хлора.
ГАМК обнаружена во всех структурах ЦНС. Концентрация аминокислоты в разных областях мозга колеблется в пределах от 2 до 10 мкМ/г ткани. Наивысшее её содержание - в чёрной субстанции. Высокая плотность ГАМК-ергических синапсов, выявлена в клиновидном ядре, ядре Дейтерса, на телах спинальных интернейронов, в обонятельных бугорках, коре головного мозга, коре мозжечка, гиппокампе, продолговатом мозге (нейронах ретикулярной формации), латеральных коленчатых телах, гипоталамусе, ядрах дорзальных рогов спинного мозга. Нейроны этих образований высоко чувствительны к ГАМК.
В нервных окончаниях ГАМК обнаруживается главным образом в цитоплазме в несвязанной форме (60 - 80%); относительно небольшое количество вещества находится в пресинаптических везикулах.
ГАМК образуется из глютамата под влиянием пиридоксальфосфат-зависимого энзима глютаматдекарбоксилазы (ДГК) (рисунок 6). ДГК - цитоплазматический энзим, широко представленный в структурах мозга, содержащих ГАМК в высокой концентрации. Источником глютамата является цикл Кребса. Катаболизм нейромедиатора осуществляется митохондриальным энзимом - трансаминазой ГАМК (ГМАК-Т). Он превращает вещество в сукцинатсемиальдегид, который, в свою очередь, окисляется другим митохондриальным энзимом, дегидрогеназой сукцинатсемиальдегида, с образованием янтарной кислоты. Последняя утилизируется циклом Кребса.
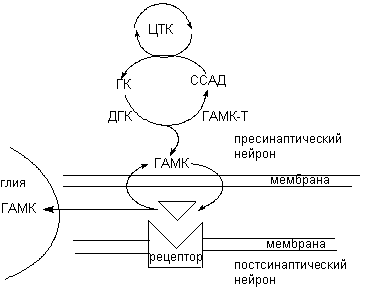
Рисунок 6. Схема обмена ГАМК в ЦНС:
ЦТК - цикл трикарбоновых кислот; ГК - глутаминовая кислота; ДГК - декарбоксилаза глутаминовой кислоты; ГМАК-Т - трансаминаза ГАМК; ССАД - сукцинатсемиальдегид
Большая часть выделившейся в синатическую щель ГАМК удаляется путем высоко афинного, Na-зависимого активного обратного захвата, как нервными окончаниями, так и клетками глии. До 50% ГАМК ЦНС определяется в глиальных элементах мозга.
Конвульсанты, действующие на ГАМК-ергический синапс, либо блокируют синтез и высвобождение ГАМК в синаптическую щель (аллилглдицин, 3-меркаптопропионовая кислота, антагонисты пиридоксальфосфата) либо являются её физиологическими антагонистами.
4.1.1.2.1.1. Антагонисты ГАМК
Структура и физиология ГАМК-рецепторов окончательно не изучены. Не существует и их единой классификации. Наиболее распространено разделение рецепторов на ГАМКА и ГАМКБ типы по их чувствительности к бикукуллину. Наиболее изучены ГАМКА рецепторы, действию на которые и приписывают основные эффекты, вызываемые тормозным нейромедиатором. С ГАМКА-рецепторами связывается большое количество химических веществ, как облегчающих, так и блокирующих поступление ионов хлора через возбудимую мембрану (рисунок 7). Эти вещества являются соответственно агонистами или антагонистами ГАМК.
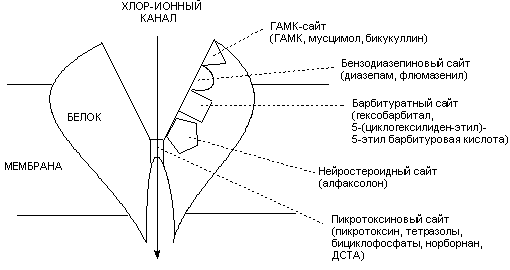
Рисунок 7. Схема строения ГАМК-рецептора, с указанием сайтов связывания ГАМК-ергических биологически активных веществ
Бикукуллин
Бикукуллин - алкалоид, выделяемый из растения Dicentra cucullaria. Его структура представлена на рисунке 8.
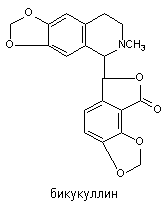
Рисунок 8. Структура молекулы бикукуллина
В настоящее время вещество широко используется в практике экспериментальных исследований. Судорожный синдром развивается при подкожном введении крысам в дозе 5 мг/кг.
Токсикокинетика соединения не изучена.
Проявления судорожного синдрома похожи на судороги вызываемые пикротоксином. По существующим представлениям бикукуллин является селективным антагонистом ГАМК в структурах спинного мозга, ствола мозга и мозжечке и не вмешивается в проведение нервного импульса в глицинергических синапсах. Чувствительность различных ГАМК-рецепторов корковых нейронов к токсиканту неодинакова (на этом признаке построена их классификация на ГАМКА- и ГАМКБ-рецепторы). Полагают, что судороги, развивающиеся при отравлении бикукуллином, имеют субкортикальное происхождение и обусловлены гиперактивацией клеток Пуркинье мозжечка, а также нейронов клиновидного ядра, ствола мозга, спинальных нейронов, гиппокампа, латеральных коленчатых тел, гипоталамуса, ретикулярной формации. Бикукуллин препятствует связыванию ГАМК синаптосомами, содержащими ГМАК-рецепторы, что указывает на его способность действовать на сайт для ГАМК. В судорожных дозах вещество не влияет на активность ГАМК-трансаминазы и ДГК, а также на уровень ГАМК в структурах мозга. Этосуксимид и вальпроевая кислота практически не препятствуют развитию судорог, вызываемых бикукуллином.
Судорожные барбитураты
Судорожные барбитураты представляют большой интерес, поскольку являются антагонистами свих аналогов - барбитуратов, усиливающих тормозные процессы в ЦНС (гексенал, барбитал и др.). Структура таких соединений представлена на рисунке 9. ЦГБК синтезирована и впервые изучена Vellus et al. в 1951 году, ДМБК - Swanson и Chen в тридцатые годы.

Рисунок 9. Структура молекул судорожных барбитуратов
Токсикокинетические характеристики веществ такие же, как и у других производных барбитуровой кислоты.
Клонико-тонические судороги у мышей ЦГБК при внутривенном введении вызывает в дозах 3 - 9 мг/кг, ДМБК - около 3 мг/кг. Судорожное действие веществ подавляется пентабарбиталом. Такие противосудорожные средства как фенитоин, триметадоин, мефенезин не предотвращают развитие эффекта. Механизм действия веществ не изучен. По всей видимости, они действуют на сайт связывания барбитуратов, выступая в качестве антагонистов ГАМК. При этом каким-то образом изменяется проницаемость возбудимой мембраны для ионов кальция, поскольку токсиканты не оказывают действия на реактивные структуры (препарат аорты кролика) в инкубационной среде, не содержащей Са2+.
Пикротоксин
Пикротоксин выделяют из Anamerta cocculus - кустарника, произрастающего в Восточной Индии. Исходный экстракт содержит два дилактона: пикротин, практически инертное вещество, и пикротоксинин активный конвульсант, структура которого представлена на рисунке 10.
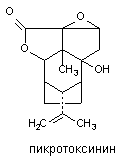
Рисунок 10. Структура молекулы пикротоксинина
Токсикокинетика вещества изучена недостаточно. Оно быстро абсорбируется при всех способах аппликации, однако судороги развиваются по прошествии определенного скрытого периода. Возможно, в этот период происходит биотрансформация вещества, его взаимодействие с ДГК или другие явления. Однако не исключено, что скрытый период - следствие медленного преодоления веществом гематоэнцэфалического барьера. Особенности распределения вещества и пути его биотрансформации неизвестны. Судя по кратковременности действия, процесс элиминации происходит с большой скоростью.
Пикротоксин вызывает клонические судороги. При увеличении дозы преобладает тонический компонент, причем тоническое сокращение сгибателей предшествует сокращению разгибателей. На фоне двигательных нарушений появляются вегетативные реакции: саливация, иногда рвота, повышение артериального давления. Предсудорожные дозы вещества стимулируют дыхание. Пикротоксин возбуждает все отделы ЦНС, однако у спинальных животных судорожный синдром вызывается более высокими дозами яда.
В опытах на животных установлено, что пикротоксин блокирует как пресинаптическое, так и резистентное к стрихнину постсинаптическое торможение в ЦНС. Известно, что стрихнин не влияет на тормозные процессы, реализуемые через ГАМК. Ни стрихнин, ни пикротоксин, применённые в отдельности не вызывают полной активации мотонейронов спинного мозга. Совместное действие стрихнина и пикротоксина приводит к полному блоку механизма торможения мотонейронов и их перевозбуждению. Таким образом, по крайней мере, половина тормозных синапсов мотонейронов ГАМК-эргичны.
ГАМК-эргические механизмы пресинаптического торможения представлены в структурах, ответственных за обработку сенсорной информации: дорзальных рогах спинного мозга, клиновидном и нежном ядрах продолглватого мозга, латеральных коленчптых телах, хвостатом ядре, талямусе. Блокадой мехенизмов торможения в сенсорных структурах можно объяснить своеобразный эффект, наблюдаемый у отравленных - появление генерализованных судорог при стимуляции сенсорных систем.
Поскольку ни ГАМК, ни её агонист мусцимол не влияют на связывание пикротоксина с ГАМК-рецептором, вероятно, токсикант не взаимодействует с сайтом, связывающим ГАМК.
Существуют данные о прямом действии пикротоксина на возбудимые нейрональные мембран. При этом вещество угнетает прохождение ионов хлора через ионный канал.
Пикротоксин практически не влияет на энзимы синтеза и разрушения ГАМК, хотя в некоторых исследования зарегистрировано подавление синтеза нейромедиатора в мозге отравленных лабораторных животных.
Тетраметилендисульфотетрамин (дисульфотетразаадаматнтан, ДСТА).
ДСТА - смолоподобное вещество, которое первоначально, до обнаружения его высокой токсичности, использовали в мебельной промышленности для обработки древесины. Структура соединения представлена на рисунке 11.
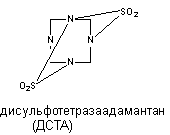
Рисунок 11. Структура молекулы дисульфотетразаадамантана
Средняя смертельная доза токсиканта для грызунов составляет 0,2 - 0,4 мг/кг.
ДСТА является неконкурентным и обратимым антагонистом ГАМК. При системном введении экспериментальным животным ДСТА чувствительность части нейронов ствола головного мозга и клиновидного ядра к ГАМК и глицину существенно снижается. Поскольку вещество не влияет на характер связывания с рецептором ГАМК, бикукуллина и пикротоксин, полагают, что ДСТА действует через собственный сайт, вероятно ионофорный канал.
Бициклические фосфорорганические соединения (БЦФ)
В 1973 году Bellet и Casida исследовали группу бициклических фосфорорганических соединений, не обладающих антихолинэстеразной активностью, но вызывающих приступ судорог и гибель экспериментальных животных при введении в малых дозах. Структура БЦФ представлена на рисунке 12. Биологически активные вещества такого строения относятся к бициклофосфатам, бициклофосфоротионатам и бициклофосфитам.
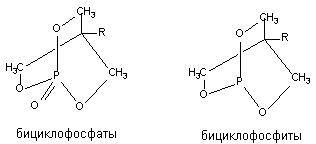
Рисунок 12. Структура молекул бициклических фосфорорганических соединений
Все они твердые вещества, плохо растворимые в воде. Могут оказывать токсическое действие при подкожном, внутримышечном, внутривенном, а некоторые представители, и при ингаляционном способе введения (в форме аэрозоля).
Токсичность веществ существенно зависит от строения радикала R и может быть очень высокой для отдельных соединений. Так, ЛД50 третбутилбициклофосфата для грызунов составляет около 50 мкг/кг массы. Проявления судорожного синдрома одинаковы при действии всех токсикантов и характеризуются быстрым развитием приступов клонических судорог, постепенно перерастающих в клонико-тонические.
Токсикокинетика веществ не изучена.
Считается, что БЦФ - неконкурентные антагонисты ГАМК. Их токсичность обусловлена блокадой хлор-ионных ГАМК-рецепторов.
Близкие по структуре соединения бициклоортокарбоксилаты и бициклоортобензоаты (рисунок 13) также способны связываться с хлор-ионофорным сайтом ГАМК-рецептора и вызывать судороги.
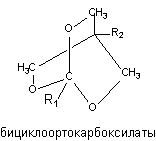
Рисунок 13. Структура молекул триоксибициклокарбоксилатов
Токсичность веществ зависит от строения радикалов R1 и R2 и для некоторых представителей, при внутрибрюшинном способе введения, ЛД50 составляет около 1 мг/кг массы экспериментального животного (4-третбутил-1(3,4-дихлофенил)-бициклоортобензоат).
Норборнан
2,2-ди(трифторметил)-3,3-дициано-5,6-дихлорнорборнан (норборнан) - один из самых токсичных синтетических конвульсантов. Вещество синтезировано в начале 80-х годов Мидлтоном (США). Структура вещества представлена на рисунке 14.
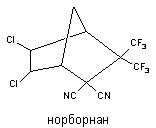
Рисунок 14. Структура молекулы 2,2-ди-(трифторметил)-3,3-дициано-5,6-дихлорнорборнана
Кристаллическое вещество, растворимое в воде, оказывает эффект при всех способах введения. Видовая чувствительность к норборнану выражена слабо и составляет в среднем 0,07 - 0,2 мг/кг.
Токсикокинетика вещества не изучена.
Интоксикация характеризуется растянутой во времени клиникой поражения, что отличает её от клиники поражения лабораторных животных другими ГАМК-литиками. Так, при подкожном введении крысам смертельной дозы норборнана, скрытый период составляет около 1,5 часов, судорожный - до 4 часов, продолжительность жизни отравленных животных - более 6 часов (для сравнения, аналогичные токсикодинамические характеристики пикротоксина составляют, соответственно: 0,5 часа; 0,5 часа и 1 час). Судорожный период характеризуется волнообразным течением. Приступы клонико-тонических судорог сменяются периодами ремиссии. Сенсорная стимуляция провоцирует формирование ризуса.
По существующим представлениям норборнан - избирательный блокатор хлор-ионофоров ГАМКА-рецепторов. Фенобарбитал препятствует развитию судорог, вызываемых норборнаном. Производные бензодиазепина - малоэффективны.
4.1.1.2.1.2. Ингибиторы синтеза ГАМК
К числу веществ, угнетающих синтез ГАМК, принадлежат, прежде всего, ингибиторы декарбоксилазы глутаминовой кислоты (ДГК), в частности: аллилглицин, 3-меркаптопропионовая кислота, кислород под повышенным давлением, соединения - антагонисты пиридоксальфосфата (коэнзим ДГК). Антагонисты пиридоксальфосфата, в силу широкого использования их в практике, представляют особый интерес. Структура некоторых из них представлена на рисунке 15. По большей части это производные гидразина.
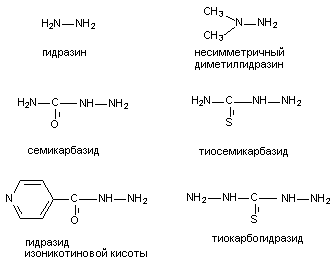
Рисунок 15. Структура некоторых веществ - антагонистов пиридоксальфосфата
При введении в дозах, близких к смертельным, вещества вызывают клонико-тонические судороги, приступы которых чередуются с периодами ремиссии. Судорогам предшествует скрытый период, продолжительностью около полутора часов. Наиболее токсичным, из представленных на рисунке, веществом является тиокарбогидразид, наименее токсичным - изониазид. ЛД50 несимметричного диметилгидразина для крыс при внутрибрюшинном введении составляет около 100 мг/кг.
Фенобарбитал, триметадион, а также пиридоксин подавляют судороги, вызываемые производными гидразина, как у человека, так и у лабораторных животных. Фенитоин практически не эффективен.
В основе токсического действия рассматриваемых веществ лежит способность взаимодействовать с пиридоксалем с образованием пиридоксальгидразонов, которые, являются ингибиторами энзима пиридоксалькиназы как in vitro, так и in vivo. Это, в сою очередь, приводит к нарушению синтеза в цитоплазме нейронов пиридоксальфосфата - коэнзима многих ферментов, среди которых ДГК и трансаминаза ГАМК (ГАМК-Т). Таким образом, гидразин и его производные угнетают не только синтез, но и разрушение ГАМК, однако действие на синтетический процесс выражено сильнее и потому содержание ГАМК в ткани мозга снижается. Обычно судороги развиваются при снижении активности ДГК на 40 и более процентов. Тем не менее, в условиях эксперимента не удается проследить четкую зависимость между выраженностью проявлений интоксикации и степенью снижения уровня ГАМК в мозге. Отчасти это связано с тем, что подавление синтеза нейромедиатора в пресинаптических структурах маскируется его накоплением в глиальных клетках вследствие угнетения инактивации ГАМК-Т.
4.1.1.2.1.3. Вещества, блокирующие высвобождения ГАМК из нервных окончаний
С действием на пресинаптические ГАМК-эргические структуры связывают судорожную активность тетанотоксина.
Тетанотоксин продуцируется анаэробными бактериями Clostridium tetani. Это белок, состоящий из двух субъединиц с молекулярной массой 100000 и 50000 дальтон. Неустойчив при нагревании.
Летальная доза для грызунов - около 2* 10-6 мг/кг массы животного. Для людей смертельная одноразовая доза токсина составляет 0,2 - 0,3 мг.
После действия токсина скрытый период может продолжаться в течение нескольких суток. Вслед за общими проявлениями недомогания развивается тризм жевательной мускулатуры, а затем и других групп мышц. Смерть наступает от остановки дыхания в результате тонического сокращения дыхательной мускулатуры. У млекопитающих токсин также вызывает приступы тонических судорог. Установлено, что при этом блокируется выброс тормозных нейромедиаторов ГАМК и глицина пресинаптическими структурами.
При внутримышечном введении лабораторным животным, вещество с помощью механизма ретроградного аксонального тока по волокнам нервных стволов проникает в ЦНС. Имеются доказательства способности токсина к транссинаптической миграции. ГЭБ для тетанотоксина не проницаем.
Механизм действия вещества изучен недостаточно. В ряде исследований показано наличие в нервных окончаниях специфических сайтов связывания токсина. Эти структуры представляют собой ганглиозиды или углеводные комплексы, близкие по строению ганглиозидам. Сиаловая кислота, как полагают, - важнейший компонент этих сайтов. Тетанотксин не связывается с ненейрональными клеточными мембранами и в этом одна из причин его высокой токсичности. Структурно рецептор тетанотоксина вероятно напоминает рецептор тиреотропина. Токсин способен связываться с препаратом мембран, приготовленных из ткани щитовидной железы, при этом тиреотропин блокирует это связывание. Вместе с тем in vivo гормон потенцирует связывание токсина мембранами нервных клеток.
4.1.1.2.2. Конвульсанты, действующие на глицинергические синапсы
Глицин является тормозным медиатором интернейронов спинного мозга и ствола головного мозга, регулирующих функциональную активность мотонейронов, локализующихся в этих анатомических образованиях. В других структурах ЦНС глицинергические синапсы не обнаружены, хотя свободная аминокислота определяется не только во всех отделах мозга, но и в цереброспинальной жидкости. При ионтофоретической аппликации глицин вызывает гиперполяризацию мембраны мотонейрона, формирует ингибиторный постсинаптический потенциал (ИПСП). В основе феномена лежит увеличение проницаемости возбудимой мембраны для ионов хлора.
Прерывание нервного импульса в глицинергических синапсах осуществляется путем высокоафинного обратного захвата медиатора пресинаптическими нервными окончаниями и клетками глии. Обмен глицина в нейронах изучен недостаточно.
Антагонисты глицина в действии на глицинергический синапс обладают свойствами конвульсантов. Наиболее известным представителем группы является стрихнин.
Стрихнин
Стрихнин - бесцветное кристаллическое вещество, горькое на вкус. Растворяется в воде и органических растворителях. Это основной алкалоид, содержащийся в плодах растения, произрастающего в индии - Strychnos nux vomica (рвотные орехи). Препараты из рвотных орехов с 16 века и до нашего времени используют в Европе для борьбы с грызунами. Поэтому бытовые отравления стрихнином, особенно детей, встречаются здесь по сей день.
Структура стрихнина представлена на рисунке 16.
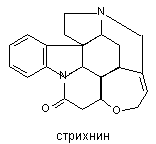
Рисунок 16. Структура молекулы стрихнина
Рвотные орехи содержат и другой алкалоид близкого стрихнину строения - бруцин (2,3-диметокси производное стрихнина). Вещество обладает значительно меньшей токсичностью (в 8 - 40 раз). В настоящее время известны и другие аналоги стрихнина, выделенные из растительного сырья и полусинтетического происхождения, но все они менее токсичны.
Стрихнин быстро всасывается в желудочно-кишечном тракте и распределяется в организме. Содержание его в мозге при этом не выше содержания в других органах и тканях. Алкалоид метаболизирует при участии микросомальных энзимов печени. Основным матаболитом является 2-гидроксистрихнин. До 20% вещества выводится из организма с мочой в неизменённом состоянии.
Смертельной дозой для человека является 15 - 100 мг.
В малых дозах вещество обладает стимулирующим действием на ЦНС. При этом резко понижается порог сенсорного восприятия: слуха, обоняния, тактильного чувства и т.д. В более высоких дозах развивается возбуждение, появляется чувство страха, повышается тонус мускулатуры, особенно затылочной группы мышц (голову тянет назад). Любой раздражитель (звук, прикосновение) может спровоцировать развитие тонических судорог. Сознание пострадавший не утрачивает, поэтому судорожные приступы болезненны и субъективно тяжело переносятся отравленным.
При подкожном введении смертельной дозы алкалоида лабораторным животным (крысам) скрытый период составляет около 20 минут, судорожный - около 5 минут; на высоте судорожного приступа животное погибает.
Проявления и механизмы отравления стрихнином исследованы достаточно хорошо. Первые опыты были выполнены Шерингтоном еще в начале ХХ века. Установлено, что в спинном мозге, ретикулярной формации, ядре подъязычного нерва, вентромедиальном и латеральном отделах таламуса, клиновидном ядре и ядре Дейтерса, стрихнин является высоко селективным, конкурентным антагонистом глицина в действии последнего на рецептор. Показано также, что этот алкалоид является конкурентным антагонистом и других тормозных аминокислот:
 -аланина и таурина. В отношении ГАМК-ергических структур активность стрихнина незначительна.
-аланина и таурина. В отношении ГАМК-ергических структур активность стрихнина незначительна.Судороги, вызываемые веществом, хорошо снимаются бензодиазепинами.
4.1.1.3. Вещества, нарушающие процессы биоэнергетики в мозге
Острое нарушение энергетического обмена в организме может сопровождаться судорожным синдромом. При тяжелом отравлении цианидами, сульфидами, молниеносной форме интоксикации СО судороги - характерное проявление токсического процесса. Механизмы явления до конца не выяснены. Возможно, судороги являются следствием патологической импульсации в ЦНС, развивающейся в результате перевозбуждения рецепторов glomus caroticum и аортального тела, под влиянием вызванного токсикантами быстрого снижения содержания макроэргов в этих специализированных регуляторных структурах. Возможно, конвульсии - это результат повреждения энергетических процессов непосредственно в нервных клетках и, как следствие, нарушения механизмов регуляции проницаемости возбудимых мембран для ионов, т.е. нервной возбудимости.
Важной, с практической и теоретической точек зрения, группой веществ, вызывающих судороги, путем нарушения энергетики мозга, являются фторорганические соединения.
Фторорганические соединения
Синтез фторорганических соединений стал в середине ХХ века необходимым элементом крупномасштабного производства пластмасс, хладоагентов, пестицидов, красителей, смазочных материалов и т.д. С позиций общей токсикологии особый интерес представляют фторпроизводные карбоновых кислот, их эфиры (метиловый эфир фторуксусной кислоты и др.) и фторированные спирты (фторэтанол и др).
Высокая токсичность некоторых фторорганических соединений стала поводом для их пристального изучения, в том числе и с военными целями. Эти соединения значительно различаются по токсичности. По данным C. Saunders (1957) решающим фактором, определяющим токсичность веществ, является их способность метаболизировать в организме с образованием фторуксусной кислоты. Именно это соединение ответственно за инициацию токсического процесса при поступлении в организм токсичных аналогов. Согласно данным автора, в ряду производных фторкарбоновых кислот (F(CH2)nCOOR) ядовиты лишь соединения с нечетным числом метиленовых групп в молекуле (n - нечетное).
Чередование токсичности в пределах гомологического ряда объяснимо с позиций теории
 -окисления в организме жирных кислот, согласно которой последние ступенчато расщепляются, последовательно отделяя от исходной молекулы радикалы ацетата. Если n - четное число, то в результате такого превращения последним метаболитом оказывается относительно малотоксичная 3-фторпропионовая кислота (ЛД50 для мышей при внутрибрюшинном способе введения - 60 мг/кг), если n - нечетное - фторуксусная. Понятно, что наиболее токсичным представителем фторкарбоновых кислот является фторуксусная кислота.
-окисления в организме жирных кислот, согласно которой последние ступенчато расщепляются, последовательно отделяя от исходной молекулы радикалы ацетата. Если n - четное число, то в результате такого превращения последним метаболитом оказывается относительно малотоксичная 3-фторпропионовая кислота (ЛД50 для мышей при внутрибрюшинном способе введения - 60 мг/кг), если n - нечетное - фторуксусная. Понятно, что наиболее токсичным представителем фторкарбоновых кислот является фторуксусная кислота.Фторуксусная кислота синтезирована Свартом в 1900 году. Позже она была выделена из листьев Южноафриканского растения Dichapetalum cymosum. Несколько листьев этого растения достаточно для приготовления снадобья, способного умертвить животное.
Фторуксусная кислота - кристаллическое вещество, хорошо растворимое в воде. Токсичность её неодинакова для разных видов. Летальная доза для мышей составляет около 0,6 мг/кг, для овец - 0,7 мг/кг, для лошадей - 1,0 мг/кг, собак - 0,1 мг/кг. Средняя смертельная доза для человека определяется, как 2 - 5 мг/кг массы.
Вещество хорошо всасывается в желудочно-кишечном тракте и быстро распределяется в организме. Проницаемость через гематоэнцефалический барьер умеренная. Вещество медленно метаболизирует в организме. Метаболиты выделяются с мочой и через легкие. У грызунов интоксикация протекает очень бурно. Уже через несколько минут после введения смертельной дозы развиваются судороги и через минуту - полторы после их начала у отдельных особей регистрируют смерть. Если смертельный исход не наступал, нормализацию состояния отмечают уже через 20 минут после прекращения судорог.
У человека, в зависимости от принятой дозы, действие на организм проявляется спустя 0,5 - 6 часов. Появляются тошнота, боли в животе, развивается оглушенность, а затем и кома. На высоте интоксикации появляются приступы клонико-тонических судорог. Даже после прекращения приступов пострадавший может оставаться в тяжелом бессознательном состоянии в течение 6 дней. Смерть наступает от остановки дыхания.
В основе механизма токсического действия фторацетата лежит его способность в форме FАцКоА проникать в митохондрии, и вступать в метаболические превращения в цикле Кребса. Установлено, что продукт превращения фторацетата в цикле - фторцитрат, ковалентно связывается с ферментом (транслоказой) внутренней мембраны митохондрий, участвующим в переносе цитрата через митохондриальную мембрану, нарушая этот процесс. Ко-фактором транслоказы является глютатион, который также связывается с фторцитратом. Известно, что синтез АцКоА идет только при условии трансмембранного тока цитрата. Кроме того, на этапе превращения цитрата в цис-аконитат развивается блок цикла трикарбоновых кислот в результате конкурентного обратимого ингибирования токсикантом фермента аконитатгидратазы. Поскольку цитрат не облегчает течения интоксикации, этот механизм нарушения митохондриальных процессов не считают основным. В результате такого комплексного действия повреждаются митохондриальные процессы, лежащие в основе образования субстратов аэробной фазы дыхания - нарушается синтез макроэргов.
К числу средств, облегчающих течение острого отравления, относятся этанол, сульфат магния, бензодиазепины, вещества, содержащие SH-группы.
4.1.2. Седативно-гипнотическй эффект. Наркотики
Седативно-гипнотический эффект развивается при действии на организм огромного числа химических веществ с различным строением и механизмами токсического действия. Острое отравление этими веществами чрезвычайно распространенное явление в наше время. Условно можно выделить две основные группы:
- агонисты тормозных нейромедиаторных систем мозга (в основном ГАМК-ергической);
- вещества с неспецифическим, так называемым "неэлектролитным" (по определению Н.В. Лазарева), действием на ЦНС.
К первой группе относятся седативные, снотворные средства, препараты для внутривенной анестезии, широко используемые в клинической практике. Основными представителями являются производные барбитуровой кислоты (фенобарбитал, пентабарбитал, секобарбитал и др.), бензодиазепины (диазепам, нитразепам, феназепам и др.), некоторые стероидные препараты (алфаксолон) и др. По существующим представлениям эти вещества избирательно взаимодействуют с бензодиазепиновым, барбитуратным и стероидным сайтами ГАМКА рецепторов ЦНС, повышая их чувствительность к тормозному нейрмедиатору. При передозировке веществ (преднамеренной или случайной) развивается интоксикация, в основе которой лежат хорошо изученные эффекты:
- седативный - подавление реакции организма на внешние раздражители, снижение уровня двигательной активности и мышления;
- снотворный - сон при интоксикациях может быть чрезвычайно глубоким и перерастать в кому;
- миорелакисрующий - полное расслабление скелетной мускулатуры отмечается лишь при тяжелых отравлениях;
- угнетение дыхания и сердечной деятельности - основная причина смерти при отравлении веществами; развивается в результате угнетения дыхательного и сосудо-двигательного центров.
Биологическая активность веществ, механизмы их действия широко освещены в фармакологической литературе.
4.1.2.1. Неэлектролиты
Представители группы "неэлектролитов" - многочисленные соединения разного химического строения, но с близкими физико-химическими свойствами. Это неполярные, хорошо растворимые в липидах вещества, инертные в химическом отношении, не диссоциирующие в воде с образованием ионов (отсюда и их название), при нормальных условиях представляющие собой летучие жидкости или газы. Основное свойство этих веществ - способность вызывать наркоз. Любой "неэлектролит" в той или иной степени обладает наркотической активностью. Некоторые представители группы широко используются в клинической практике, как общие ингаляционные анестетики (галотан, энфлуран, метоксифлуран и др). Подавляющее же большинство "неэлектролитов" применяются в промышленности (многочисленные органические растворители и т.д.), сельском хозяйстве и для них наркотическая активность лишь один из механизмов токсического действия при случайных или преднамеренных интоксикациях. Один из известнейших неэлектролитов - этиловый спирт, в течение многих столетий используется человеком с целью вызвать транзиторную токсическую реакцию - опьянение.
Группы веществ, обладающих наркотической активностью и их отдельные представители, приведены в таблице 13.
Таблица 13. Химическая классификация веществ, обладающих наркотической активностью
1. Инертные газы: - ксенон - азот, криптон, аргон, неон - под повышенным давлением 2. Неорганические оксиды: - закись азота 3. Алифатические углеводороды: - метан, н-гексан - этилен, амилен - ацетилен, кротонилен 4. Циклические углеводороды: - циклопропан, циклобутан, бензол - ксилол 5. Эфиры: - диэтиловый, дивиниловый, этилвиниловий 6. Спирты: - метанол, этанол, пропанол - этиленгликоль 7. Галогенированные углеводороды: - четыреххлористый углерод, дихлорэтан, хлороформ, этилхлорид - галотан (CF3CHBrCl), норфлюран (CF3CH2F) 8. Галогенированные эфиры: - метоксифлюран, энфлюран, флюроксен 9. Другие: - сероуглерод |
Отравление "неэлектролитами" любого строения сопровождается быстрым развитием практически одинаковых эффектов. Это состояние, напоминающее опьянение, анальгезия, потеря сознания, подавление сенсорных и автономных рефлексов, кома, миорелаксация, угнетение дыхания и сердечной деятельности. Если интоксикация не приводит к гибели пострадавшего, практически все эффекты исчезают через непродолжительное время (часы) после прекращения действия токсикантов (особенно это справедливо при ингаляционном воздействии высоко летучих веществ). По выходе из тяжелого состояния наблюдается амнезия.
Очень часто в патологический процесс вовлекается не только ЦНС, но и другие органы и системы и не только в результате нарушения механизмов нейрорегуляции, но и вследствие "специфического" действия веществ или их метаболитов на печень, почки, сердечную мышцу, систему крови, легкие и т.д. Поэтому многие "неэлектролиты" в руководствах по токсикологии фигурируют как гепато-, нефро-, пульмонотоксиканты (см. соответствующие разделы). Наконец, на нервную систему, помимо седативно-гипнотического, некоторые "неэлектролиты" оказывают и иное действие, связанное с нарушением пластических и биоэнергетических процессов в нервной ткани, что приводит к развитию порой тяжелых энцефало- и нейропатий. Эти эффекты развиваются вслед за периодом неэлектролитного действия и составляют вторую, отсроченную, порой длительно текущую, фазу интоксикации.
За более чем полуторовековую историю изучения состояний наркоза, опьянения и т.д. для объяснения угнетающего действия на ЦНС (и вообще возбудимые ткани) веществ с совершенно различным строением, но обладающих общностью физико-химических свойств, были предложены самые разнообразные физиологические, биохимические и физико-химические механизмы. Некоторые гипотезы механизма действия веществ суммированы в таблице 14.
Таблица 14. Основные гипотезы механизма действия "неэлектролитов" (наркотиков)
Год |
Краткое название |
Авторы |
1847 1864 1866 1873 1883 1901 1961 1971 1990 |
Растворение клеточного жира Экхимоз клеточных мембран Индурация клеточной стенки Полукоагуляция протоплазмы Корреляция с растворимостью в воде Корреляция с растворимостью в липидах Стабилизация "льдоподобной" структуры тканевой воды Гипотеза критического объема клеточных мембран Специфическое взаимодействие с белками-мишенями |
von Bibra Harles Faure, Sansom Bernard Richet Meyer, Overton Pauling, Miller Lever et al Franks, Lieb |
Установлено, что все рассматриваемые токсиканты действуют на клетки, изменяя свойства возбудимых мембран и электрон-транспортных мембран митохондрий. Наиболее чувствительными оказываются нейроны ЦНС.
В классических исследованиях H. Meyera (1899), Overtona (1896), K. Meyera (1937), Н.В. Лазарева (1938) было установлено, что наркотическая активность веществ прямо пропорциональна величине их коэффициента распределения в среде масло/вода (степень гидрофобности молекулы) (смотри, в частности, данные, представленные на таблице 15). Это дало основание сформулировать правило Овертона-Мейера: "Наркоз развивается, когда любое химически инертное вещество накапливается в липидной клеточной мембране в определенной молярной концентрации". В качестве подтверждения справедливости этого правила к настоящему время приведено огромное количество фактов.
Таблица 15. Характеристика наркотической активности некоторых химических веществ (в опытах на мышах)*
Вещество |
Коэффициент (масло/вода) |
Эффективная концентрация (объемные %) |
метан этилен оксид азота пентан диэтиловый эфир хлороформ |
0,54 1,3 1,4 37 50 265 |
370 80 100 13,2 3,4 0,5 |
* По данным Meyer, Gotlier, 1926
Вместе с тем до настоящего времени не получены исчерпывающие ответы на вопросы, без которых не возможно говорить о раскрытии механизмов действия неэлектролитов:
1. Какова степень избирательности действия наркотиков на различные отделы нервной системы; какие структуры наиболее чувствительны к веществам?
2. Какова степень избирательности действия наркотиков на различные части нейрона?
3. Какие механизмы синаптической передачи нервного импульса прежде всего нарушаются?
4. Каковы молекулярные механизмы действия неэлектролдитов?
Общая характеристика феномена содержится в современной версии теории "распределения" Овертона-Мейера, согласно которой биологический эффект (угнетение ЦНС) развивается, когда концентрация вещества в липидной мембране нейрона достигает 40 - 60 мМ (мМ/кг сухого веса мембраны). При этом постулируется, что молекулярные сайты действия любого анестетика представляют собой либо с липиды, формирующие клеточные мембраны, либо гидрофобные участки белковых молекул, являющихся компонентами этих биомембран. Такие представления позволяют объяснить, почему наркотическая активность веществ возрастает при понижении температуры тела человека или экспериментального животного (примерно на 8% на градус). Снижение температуры увеличивает растворимость веществ в гидрофобной фазе и, вследствие этого, требуется меньшее количество токсиканта, для того, чтобы создать в критической области необходимую его концентрацию.
Однако интимные механизмы взаимодействия неэлектролитов с мембранами остаются не известными.
Так, как уже сказано, гидрофобными сайтами мембраны, которые взаимодействуют с неэлектролитами, могут быть как липиды, так и участки белковых молекул. Белки непосредственно контролируют функции возбудимых мембран (ионные токи, высвобождение нейромедиаторов, свойства рецепторов), в то время как физико-химические свойства окружающих липидов, влияют на активность белков. Существует большое количество исследований, в которых доказывается значение действия "неэлектролитов" именно на липиды. Липиды находятся в постоянном тепловом движении (флюидность мембраны). Показано, что растворение в биомембране неэлектролита приводит к увеличение её текучести, что, по мнению авторов, должно сказываться на функциональных свойствах мембраны в целом.
Альтернативные представления связаны с объяснением действия веществ путем их взаимодействия с определенными белковыми молекулами. В качестве таких молекул предлагаются белки особого строения (pocket-proteins; модельный белок - люцифераза,) с неизученными пока функциями, белки-регуляторы состояния натриевых каналов, холинорецепторные протеины и рецепторы ГАМК.
Ни одно из представлений не является в настоящее время окончательно доказанным. Исследователи приходят к выводу, что, по-видимому, оба механизма (действие на липиды и действие на белки) играют свою роль, а относительная значимость обратимого взаимодействия анестетика с каждым из компонентов биологической мембраны вероятно неодинакова для токсикантов с различным строением и для различных биологических мембран.
Согласно гипотезе, "критического объема" - наркоз наступает тогда, когда объем возбудимых мембран нервных клеток увеличивается примерно на 0,4% вследствие накопления в них химически инертных молекул. Доказательством справедливости этой гипотезы являются данные, полученные при прямом измерении концентрации молекул токсиканта (например, летучего анестетика) в мембранах эритроцитов при воздействии эффективных доз. Эта гипотеза подтверждается и данными Миллера и Вильсона (1978), согласно которым при действии на экспериментальное животное, находящееся в состоянии наркоза, высокого барометрического давления (более 10 атмосфер) можно восстановить его сознание. Барометрическое давление "уплотняет" мембраны, возвращая их к исходному объему. В развитии этого представления сформулирована гипотеза, согласно которой неэлектролит избирательно накапливается в ограниченном количестве сайтов мембран определенного строения и именно здесь реализует свое действие, при этом изменяется объем мембраны, свойства липидов и активность вполне конкретных белков.
В настоящее время хорошо известно, что общие анестетики (наркотики, "неэлектролиты") в действующих дозах угнетают передачу нервного импульса в синапсах, при этом проводимость по нервным волокнам не изменяется. Однако не ясно, какой из процессов, высвобождения нейромедиатора или его взаимодействие с рецептором постсинаптической мембраны, страдает в большей степени. Не ясно и какие синапсы, возбуждающие или тормозные более чувствительны к действию токсикантов. В некоторых исследованиях показана способность этанола устранять судороги, вызываемые пикротоксином и бикукуллином. Авторы (Hunt, 1983 и др.) утверждают, что эти и другие данные являются доказательством избирательности действия этилового спирта на ГАМК-рецепторы.
Электрофизиологические исследования головного мозга животных, подвергшихся действию неэлектролитов, позволили выявить структуры, наиболее чувствительные к токсикантам. Ими оказались образования вентробазального таламуса и нейроны V слоя коры головного мозга. Эти данные позволили предположить, что нейрофизиологическим механизмом седативно-гипнотического действия токсикантов является угнетение гипотетической кортико-таламической и ретикулярно-таламической нейронной петли, функция которой состоит в контроле реактивности вентробазальных клеток таламуса - основного релейного образования мозга, ответственного за восприятие сенсорных сигналов (Angel, 1984).
Таким образом, не смотря на многочисленные исследования, большое количество полученных данных, широкое использование феномена в медицинской практике, представления об интимных процессах, лежащих в основе седативно-гипнотического эффекта все еще требуют уточнения.
Бензол
Острое поражение бензолом приводит к нарушению функций ЦНС, проявляющемуся возбуждением, сменяющимся угнетением сознания, комой, смертью от остановки дыхания, сердечной деятельности и сосудистого коллапса. Бензол в полной мере проявляет свойства "неэлектролита". При действии вещества в концентрации 20000 ррм смерть развивается в течение нескольких минут. Кратковременное воздействие меньших доз (3000 - 10000 ррм) сопровождается эйфорией, головокружением, головной болью, тошнотой, рвотой, потерей сознания. Отмечается выраженная индивидуальная чувствительность к токсиканту. Важным фактором, определяющим тяжесть поражения, является продолжительность действия. Ингаляция паров бензола в концентрации 7500 ррм в течение 30 мин. представляют угрозу для жизни; - 1500 ррм в течение 60 мин. приводит к тяжелой интоксикации; - 50 - 150 ррм в течение 5 часов сопровождается головной болью и слабостью; - 25 ррм в течение 8 часов не вызывает отчётливых симптомов интоксикации.
При несмертельных формах поражения нормализация состояния проходит быстро и как правило является полной. Эффекты, развивающиеся в результате специфического действия бензола, проявляются позже (см. соответствующие разделы).
Для военных формирований, участвующих в ликвидации последствий аварий с заражением территории бензолом, рекомендуемые предельные уровни воздействия составляют: 1000 ррм - в течение 10 минут, 500 ррм - в течение 30 минут, 300 ррм - в течение часа.
Этиловый спирт
Этиловый спирт (этанол - СН3СН2ОН) - бесцветная прозрачная жидкость со специфическим запахом. Хорошо растворяется в воде и органических растворителях. Температура кипения +78,40. В основном используется, как сырье для производства ликеро-водочных изделий и в качестве органического растворителя. Основная причина острых отравлений - прием вещества внутрь с целью вызвать опьянение. Тяжесть интоксикации определяется концентрацией этилового спирта в крови отравленного (таблица 16).
Таблица 16. Концентрация этанола в крови человека и соответствующие проявления интоксикации
Концентрация этанола в крови (г/л) |
Клинические проявления |
0,20 - 0,99 |
Легкое изменение настроения, эйфория, прогрессирующее нарушение координации движений, расстройство сенсорных функций, нарушение поведения. |
1,00 - 1,99 |
Отчетливые нарушения умственной активности, нарушение координации движений вплоть до атаксии |
2,00 - 2,99 |
Углубление атаксии, тошнота, рвота, диплопия |
3,00 - 3,99 |
Гипотермия, 1 стадия наркоза, по выходе из состояния - амнезия |
4,00 - 7,00 |
Кома, нарушение дыхания, смерть |
Этиловый спирт полностью абсорбируется из желудочно-кишечного тракта в течение 30 - 120 минут после приема. Абсорбция осуществляется путем простой диффузии. После распределения вещество накапливается преимущественно в водной фазе организма. Однократный прием 15 г этилового спирта мужчиной массой 70 кг приводит к появлению в его крови этанола в концентрации 0,3 г/л. Этиловый спирт легко преодолевает гистогематические барьеры, в том числе гематоэнцефалический и плацентарный.
Метаболизм этанола в основном осуществляется в печени. Под влиянием алкогольдегидрогеназы, альдегиддегидрогеназы, каталазы и цитохром-Р-450-зависимых оксидаз вещество превращается сначала в уксусный альдегид, а затем уксусную кислоту, утилизирующуюся клетками организма. Элиминация спирта осуществляется с постоянной скоростью 0,1 - 0,2 г/л крови в час, т.е. подчиняется кинетике нулевого порядка (нелинейная кинетика).
В малых дозах вещество вызывает появление транзиторной токсической реакции, известной как состояние опьянения. Даже легчайшие формы опьянения сопровождаются снижением скорости мышления, нарушением реакции на внешние раздражители, быстрым утомленим.
При действии в более высоких дозах развивается классический "неэлектролитный" эффект (см. выше). При крайне тяжелых формах отравления может наступить смерть от остановки дыхания и сердечной деятельности
Медицинские мероприятия при оказании помощи направлены на прекращение всасывания алкоголя из желудочно-кишечного тракта, ускорение его элиминации, нормализацию функций сердечно-сосудистой и дыхательной систем, коррекцию метаболических нарушений. Антидотов этанола, как и других "неэлектролитов", не существует.
4.1.3. Психодислептический синдром. Психодислептики
Научное изучение психоактивных веществ началось лишь во второй половине ХХ века. Однако уже сейчас многие соединения широко используются в клинической практике, а некоторые - испытывались на предмет возможности их применения с военными целями, как боевых отравляющих веществ или диверсионных агентов.
Используемые в качестве медикаментов средства обычно подразделяют на следующие группы:
- нейролептики;
- антидепрессанты;
- психостимуляторы;
- транквилизаторы;
- ноотропные препараты.
В рекомендованных врачем дозах, эти вещества угнетают или активируют, в зависимости от свойств, восприятие, эмоции, память, обучение, мышление (ассоциативные процессы), сохраняя в целом адекватное отношение личности к окружающей действительности. В больших дозах в той или иной степени эти вещества могут провоцировать нарушение процессов восприятия, эмоций, памяти и т.д., то есть вызывать психодислептический эффект, характеризующийся неадекватной реакцией личности на внешние раздражители. Такой же способностью обладают наркотические аналгетики, некоторые средства для наркоза, алкоголь, а среди промышленных токсикантов, вещества, обладающие свойствами неэлектролитов (см. выше). Способность вызывать психодислептический эффект у разных веществ выражена неодинаково. В ряде случаев, при интоксикациях, формируются лишь минимальные проявления, развивающиеся при действии веществ в дозах, близких, к вызывающим угнетение сознания или тяжелые соматические нарушения. Известны и соединения, для которых психодислептический эффект является основным в профиле их токсической активности, и развивается при действии в дозах, практически не вызывающих других токсических реакций. Изучение таких веществ имеет особое значение для понимания механизмов формирования нарушения психики при острых интоксикациях. Условно их иногда называют психодислептиками, психотомиметиками, психогениками, психоделиками, подчеркивая особую способность извращать функции высшей нервной деятельности.
Итак, психодислептики - это вещества, способные в минимальных дозах, в сотни - тысячи раз меньше тех, в которых они вызывают угнетение сознания или соматические расстройства, извращать психические процессы восприятия, эмоций, памяти, обучения, мышления, делать поведение неадекватным реальной ситуации. На таблице 17 представлена классификация таких веществ.
Таблица 17. Химическая классификация психоделиков
1. Производные триптамина - диметилтриптамин - буфотенин - псилоцин - псилоцибин - диэтиламид длизергиновой кислоты (ДЛК) - гармин 2. Фенилалкиламины - мескалин - 2,5-диметокси-4метиламфетамин - 2,5-диметокси-4этиламфетамин - триметоксифенизопропиламин 3. Пиперидилгликоляты - атропин - скополамин - хинуклединилбензилат - ВZ 4. Разные - фенциклидин (сернил) -  -тетрагидроканнабинол
-тетрагидроканнабинол |
Строение некоторых веществ, относящихся к этой группе, представлено на рисунке 17.
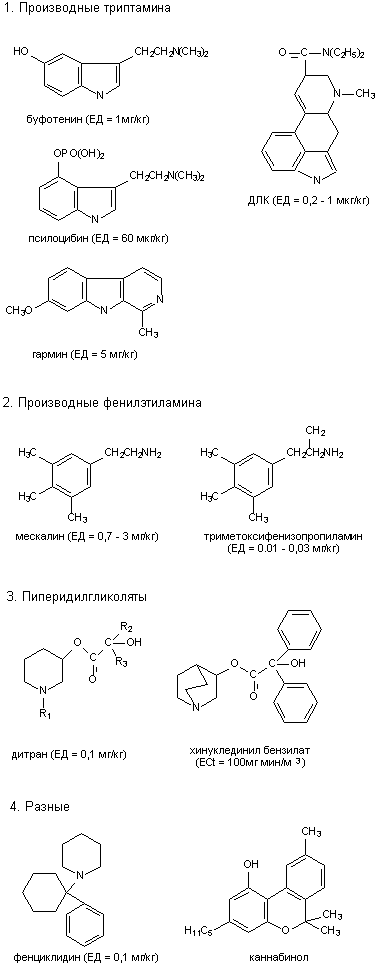
Рисунок 17. Структура некоторых химических веществ, обладающих психодислептической активностью
Психотоксический профиль психодислептиков неодинаков. При отравлении некоторыми из них доминирует изменение эмоционального статуса и некоторых тонких характеристик психической активности; другие - вызывают нарушения процессов восприятия с умеренным извращением ассоциативных процессов; третьи - формируют глубокое извращение психической активности, затрагивающие все её стороны.
Это дает основание выделить группы веществ в соответствии с особенностями формируемых ими токсических процессов:
1. Эйфориогены:
 -тетрагидроканнабинол, морфин, кокаин, этанол
-тетрагидроканнабинол, морфин, кокаин, этанол2. Галлюциногены (иллюзиогены):
ДЛК, псилоцин, псилоцибин, буфотенин, мескалин
3. Делириогены:
атропин, скополамин, дитран, BZ, фенциклидин, фторацизин и др.
4.1.3.1. Эйфориогены
Определенный токсикологический интерес среди веществ этой группы представляет
 -тетрагидроканнабинол. Это вещество выделяют из масла индийской конопли (Cannabis indica). Высушенный сок из листьев растения получил название гашиш. Наркоманы применяют гашиш (каннабинол) либо путем курения, либо - через рот. Ингаляционно вещество всасывается быстрее. Через ЖКТ 95% токсиканта проникает в кровь в течение 2 - 3 часов. Выведение из организма - двухфазный процесс: период полуэлиминации в первой фазе составляет 30 минут, во второй - 36 - 48 часов. Эффективная доза каннабинола для человека равна 0,001 - 0,01 мг/кг.
-тетрагидроканнабинол. Это вещество выделяют из масла индийской конопли (Cannabis indica). Высушенный сок из листьев растения получил название гашиш. Наркоманы применяют гашиш (каннабинол) либо путем курения, либо - через рот. Ингаляционно вещество всасывается быстрее. Через ЖКТ 95% токсиканта проникает в кровь в течение 2 - 3 часов. Выведение из организма - двухфазный процесс: период полуэлиминации в первой фазе составляет 30 минут, во второй - 36 - 48 часов. Эффективная доза каннабинола для человека равна 0,001 - 0,01 мг/кг.В процессе развития транзиторной токсической реакции выделяют два периода действия. В первом, коротком, наблюдается эйфория, возбуждение, усиление восприятия. Во втором периоде (продолжительном) развивается сонливость, расслабление мускулатуры, сноподобное состояние, нарушение чувства времени, парестезии, нарушение концентрации внимания, нарушение речи, иллюзии.
Повторный прием приводит к развитию толерантности (в том числе к этанолу) и зависимости от наркотика. Синдром отмены характеризуется раздражительностью, беспокойством, нарушением сна, тремором, саливацией, рвотой. Больные теряют в весе.
4.1.3.2. Галлюциногены
Галлюциногенами называют вещества, в клинике отравления которыми преобладают нарушения восприятия в форме иллюзий и галлюцинаций, при этом пострадавшие, как правило, не утрачивают контакт с окружающими. К числу галлюциногенов относятся некоторые производные триптамина и фенилэтиламина (см. выше), нарушающие проведение нервного импульса в центральных серотонинергических и катехоламинергических синапсах. Характерной особенностью интоксикации галлюциногенами является отсутствие амнезии на пережитые события.
Большинство галлюциногенов - вещества животного и растительного происхождения, используемые человеком с древних времён для самоотравления с ритуальными целями. Некоторые токсиканты и сегодня используются наркоманами. 3 - 4 ежедневных приема веществ приводит к развитию толерантности, которая однако быстро проходит. Перекрестная толерантность отмечается между мескалином, псилоцибином, ДЛК, некоторыми другими психодислептиками. Наиболее опасным из галлюциногенов считается синтетическое вещество - метилен диоксиамфетамин (МДА). Острые отравления МДА иногда заканчиваются смертью.
Классическим представителем группы является диэтиламид лизергиновой кислоты.
Диэтиламид лизергиновой кислоты (ДЛК)
Психодислептические свойства ДЛК стали известны человечеству 16 апреля 1943 года. Именно в этот день Гофман, работавший в лаборатории Штоля в Базеле, случайно принял ничтожное количество вещества внутрь. В результате развилась интоксикация, сопровождавшаяся нарушением психики. С этого началось экспериментальное изучение галлюциногенов. Долгое время ДЛК рассматривали, как потенциальное ОВ, диверсионный агент, и потому свойства его подверглись глубокому исследованию.
ДЛК - белый порошок без запаха, его соль (тартарат) хорошо растворима в воде. При приеме вещества внутрь в дозе 0,5 мкг/кг развиваются тяжелые психозы. Выводящая из строя токсодоза, при ингаляционном воздействии, составляет 0,01 - 0,1 г мин/м3. Летальная доза для мышей - 50 мг/кг, для крыс - 15 мг/кг.
Вещество быстро всасывается в кровь. Максимальная концентрация в тканях отмечаются через 10 - 20 минут после приема. В ткани мозга в этот момент содержится менее 1% от введенного количества. Через 3 часа 80% вещества определяется в стенках и содержимом кишечника, 3% - в печени, 8% - в костях.
У экспериментальных животных вещество нарушает спонтанное поведение и условно-рефлекторную деятельность. Аминазин ослабляет действие ДЛК, резерпин - усиливает.
Клиника отравления ДЛК у человека складывается из нарушения психики, соматических и вегетативных нарушений (таблица 18).
Таблица 18. Основные проявления интоксикации ДЛК у человека (Rothlin, 1957)
Психические нарушения |
Нарушение двигательных функций |
Вегетативные нарушения |
-беспокойство -эмоциональная неустойчивость: эйфория, сменяющаяся депрессией -спутанность сознания -галлюцинации -деперсонализация -нарушение чувства времени |
пирамидные и экстрапирамидные знаки: -атаксия -спастические состояния |
а) мезодиэнцефальные эффекеты: -мидриаз -тахикардия -гипергликемия -пиломоторные реакции б) бульбарные эффекты: -гипотония -брадикардия -угнетение дыхания |
Первые признаки отравления появляются через 15 - 60 мин после приема токсиканта. Симптомы достигают максимума через 2 - 5 часов. Общая продолжительность интоксикации составляет 12 - 24 часа. Возможны спонтанные рецидивы, а также затяжные психозы в результате воздействия галлюциногена в обычной дозе.
В основе токсических эффектов, развивающихся при интоксикации ДЛК, лежит способность блокировать центральные серотонинергические рецепторы. Однако далеко не все серотонинолитики обладают свойствами психодислептиков, поэтому этот механизм, вероятно не является единственным. Особенностями действия ДЛК являются:
- способность угнетать спонтанную активность серотонинергических нейронов мозга и повышать уровень серотонина в ЦНС. 10 - 20 тысяч клеток (менее 0,1% нейронов), компактно залегающие в ядрах шва головного мозга, иннервируют все структуры ЦНС, особенно плотно - образования зрительного анализатора, лимбической системы, гипоталамуса. ДЛК не только блокирует проведение нервных импульсов в синапсах, образуемых окончаниями аксонов этих нейронов, но и подавляет их активность. В результате в нервных окончаниях накапливается нейромедиатор (в норме содержание серотонина в структурах мозга составляет 5 - 30 нг/мг белка);
- дофаминомиметическое действие. ДЛК активирует ДА-ергические нейроны нигростриальной, мезолимбической, тубероинфундибулярной систем мозга, при этом активируется процесс синтеза нейромедиатора, ускоряется его оборот в стриатуме, гипоталамусе, лимбических ядрах.
- слабое центральноле холинолитическое действие.
Оказание помощи осуществляется назначением нейролептиков (трифтазин) и седативных препаратов (бензодиазепины). Специфические противоядия ДЛК отсутствуют.
4.1.3.3. Делириогены
Делирий способны вызывать все вещества, обладающие центральной М-холинолитической активностью. Наиболее токсичным представителем группы является вещество BZ - производное хинуклединилбензилата, находившееся на снабжении армий некоторых государств в качестве ОВ несмертельного действия.
Наряду с веществами, представленными на таблице 17, к числу делириогенов могут быть отнесены лекарственные препараты из группы нейролептиков (производные фенотиазина) и некоторые трициклические антидепрессанты (фторацизин и др.), которые в высоких дозах также проявляют свойства холинолитиков. Основными симптомами интоксикации являются:
- спутанность сознания;
- нарушение оценки своего состояния;
- эйфория;
- беспокойство;
- нарушение координации движений;
- галлюцинации;
- нарушение контакта с внешним миром;
- гиперрефлексия;
- гипертермия;
- судороги;
- кома;
- амнезия.
В зависимости от действующей дозы токсикантов можно выделить несколько степеней тяжести острого отравления (таблица 19).
Таблица 19. Степени тяжести и стадии течения интоксикаций атропиноподобными препаратами (Цит. по Крылову С.С. и соавт., 1999)
Степени тяжести |
Основные проявления |
Фазы течения |
Субпсихотическая |
Снижение работоспособности, ухудшение самочувствия |
Не прослеживаются |
Легкая |
Оглушенность, маниакально- и галлюцинозоподобные комплексы |
Астения с резидуальными состояниями |
Средняя |
"Субделирий" |
Оглушенность - "субделирий" - критический сон - астения |
Тяжелая |
Делирий, делириозноаментивные состояния |
Оглушенность - делирий - критический сон - астения (возможна энцефалопатия) |
Сверхтяжелая |
Кома, сопор |
Кома - делирий (при недостаточности лечения) - астения |
BZ
Табельное психотомиметическое ОВ армии США. Это твердое кристаллическое вещество без цвета и запаха, устойчивое в водном растворе. Планируемый способ применения - аэрозоль. Токсодоза для человека составляет около 100 мг мин/м3.
При поступлении во внутренние среды организма вещество легко проникает через гематоэнцефалический барьер. Так, уже через 3 минуты после внутривенного введения экспериментальным животным вещество достигает высоких концентраций во всех структурах мозга.
Динамика развития отравления BZ в относительно высокой дозе представлена на таблице 20.
Таблица 20. Развитие интоксикации BZ средней степени тяжести
1 - 4 час - головокружение, спутанность сознания, оцепенение, переходящее в ступор, сухость во рту, тахикардия, нарушение походки и речи, рвота, гипертермия |
4 - 12 час - затруднение концентрации внимания, потеря логической связи мыслей, потеря связи с окружающей средой, галлюцинации, бред, агрессивное поведение, эмоциональная неустойчивость, нарушение координации движений, выраженная тахикардия |
12 - 96 час - усиление симптоматики, психомоторное возбуждение, беспорядочное, непредсказуемое поведение; постепенное возвращение к нормальному состоянию в течение 2 - 4 дней; по выходе из состояния - амнезия |
Помимо центральных эффектов, при отравлении BZ, отмечаются соматические, главным образом вегетативные, нарушения. При выраженных нарушениях сердечной деятельности, как правило в условиях повышенной температуры окружающего воздуха, при тяжелых интоксикациях возможны смертельные исходы.
BZ - мощный центральный холинолитик, прочно связывающийся с М-холинорецепторами мозга. Характер его распределения в ЦНС соответствует плотности М-холинорецепторов в структурах мозга: полосатое тело > кора больших полушарий > гиппокамп > гипоталамус > мозжечек. Нарушению проведения нервного импульса в холинэргических синапсах, развивающееся при отравлении, сопутствует существенное истощение запасов ацетилхолина в ЦНС (в норме: 10 - 30 нМ/г ткани; скорость оборота: 2 - 20 нМ/г мин). Поскольку в ЦНС существует тесное функционально-морфологическое взаимодействие нейронов, передающих нервный импульс с помощью различный нейромедиаторов, по-мимо нарушений холинэргических механизмов мозга при отравлении BZ, как и другими холинолитиками, отмечаются нарушения в системе норадренергической, дофаминергической, серотонинергической медиации. Специфическими противоядиями при отравлении холинолитиками вообще и BZ в частности являются обратимые ингибиторы холинэстеразы, способные проникать через гематоэнцефалический барьер, такие как галантамин (0,5% - 2 мл), физостигмин (0,05% - 2 мл), аминостигмин и др. Возможно назначение симптоматических средств (бензодиазепины). Назначение нейролептиков, особенно фенотиазинового ряда, противопоказано.
Фенциклидин
Это вещество, один из аналогов катамина, впервые синтезировано в 50-е годы, как средство для наркоза. В процессе испытаний была выявлена его высокая психодислептическая активность. При приеме вещества в количестве 5 мг развивается состояние, напоминающее опьянение, появляются галлюцинации, нарушается чувство времени. Проявления интоксикации фенциклидином представлены на таблице 21.
Таблица 21. Проявления интоксикации фенциклидином
5 - 10 мг - атаксия, нистагм, деперсонализация, нарушение чувства времени, ухудшение настроения, галлюцинации, парестезии, тошнота, рвота. Начало: 1 - 2 часа; продолжительность: 4 - 8 часов |
10 - 20 мг - ступор, гиперрефлексия, гипертензия, стереотипии, нистагм, миоз. Начало: 0,5 - 1 час; продолжительность: 8 - 24 часа |
более 50 мг - нистагм, гипотензия, брадикардия, затруднение дыхания, судорожные приступы, кома. Продолжительность: до 4 суток |
более 100 мг - гипертермический криз, угнетение дыхания, смерть в течение 3 - 10 суток от остановки дыхания |
В основе токсического действия фенциклидина лежит способность блокировать проведение нервных импульсов в глютаматергических синапсах центральной нервной системы. Однако при действии больших доз токсиканта отмечаются нарушения со стороны и других нейромедиаторных систем.
С целью оказания помощи при интоксикации средней степени тяжести рекомендуют назначение диазепама. При тяжелых интоксикациях - симптоматическая терапия.
4.1.4. Нарушение нервной регуляции периферических органов и систем
Важнейшим проявлением действия нейротоксикантов является нарушение механизмов нервной регуляции жизненно важных органов и систем: сердечно-сосудистой, дыхательной, двигательней и др. Эти нарушения прослеживаются при формировании любого острого нейротоксического процесса. Интоксикация конвульсантам, наркотиками, психодислептиками и др. как правило, сопровождается изменением частоты и глубины дыхания, нарушениями сердечного ритма и артериального давления, многочисленными вегетативными реакциями и т.д. Именно эти эффекты и становятся причиной гибели пострадавших при тяжелых отравлениях рассмотренными выше токсикантами (остановка дыхания, сердечной деятельности).
Существуют вещества, в основе действия которых на организм лежит способность "избирательно" нарушать периферические механизмы нервной регуляции органов и систем. К числу таковых относятся токсиканты, не проникающие (или плохо проникающие) через гематоэнцефалический барьер, но влияющие на передачу импульсов с нервной клетки на иннервируемый орган и повреждающие проведение сигнала по возбудимым мембранам нервных волокон, мышечной и железистой ткани.
4.1.4.1. Нарушение механизмов синаптической передачи
Все вещества, нарушающие передачу нервных импульсов в холинергических и катехоламинергических синапсах периферического отдела нервной системы, вызывают рассматриваемые эффекты. Свойства большинства этих веществ хорошо известны из курса фармакологии. К числу наиболее токсичных из известных токсикантов относятся некоторые карбаматы (см. выше), нейротоксины, выделенные из яда змей, и ботулотоксин.
Яды змей
Яды змей, относящихся к семейству Elapidae (тигровая змея, тайпан, морские змеи), содержат нейротоксины, избирательно действующие на механизмы передачи нервного импульса в холинэргических нервно-мышечных синапсах (таблица 22).
Таблица 22. Свойства основных нейротоксинов ядов змей
Токсин |
Молекулярная масса |
Масса субъединиц |
ЛД50 для мышей (мкг/г) |
 -бунгаротоксин
-бунгаротоксинКротоксин Нотексин Тайпоксин |
20500 22000 13600 46000 |
13500+7000 14000+8000 13600 18000+14000+13000 |
0,025 0,05 0,025 0,002 |
(По Howard B.D., 1982)
Все перечисленные в таблице токсины проявляют активность фосфолипаз А2, причем каталитический центр энзимов является функционально значимым для реализации их токсического действия. Интересно отметить, что большинство известных фосфолипаз А2, выделяемых из других источников (поджелудочной железы млекопитающих, пчелиного яда и т.д.), не смотря на высокую специфическую энзиматическую активность, не обладают нейротоксичностью.
Нейротоксические фосфолипазы змеиных ядов угнетают спонтанное и вызванное возбуждением высвобождение ацетилхолина нервными окончаниями мотонейронов, а также некоторыми холинергическими нейронами вегетативной нервной системы. Токсины не проникают через гематоэнцефалический барьер и потому их эффект реализуется лишь на периферии, главным образом в нервно-мышечных синапсах.
Основные клинические признаки отравлений, обусловленные действием нейротоксинов при укусах змей, включают: миальгию при движении, птоз, паралич языкоглоточного нерва, парез конечностей, нарушение сердечной деятеьности, гиперкалиемию, паралич дыхательной мускулатуры.
Блок проведения нервного импульса в нервно-мышечных синапсах развивается в три стадии. В течение первых 5 - 10 минут после воздействия отмечается уменьшение количества ацетилхолина, высвобождаемого при возбуждении нервного волокна. В последующие 30 - 60 минут, при активации нейрона, регистрируется повышенный выброс нейромедиатора. Затем, в течение 60 - 120 минут отмечается постепенное снижение высвобождения ацетилхолина до полного прекращения. В тех случаях, когда в эксперименте используют токсины, фосфолипазная активность которых угнетена химическими модификаторами, удается воспроизвести только первую стадию токсического действия ядов.
Клинически продолжительность латентного периода от момента введения токсина до развития эффекта составляет, как правило, не менее 60 минут. Увеличение дозы вводимого вещества не приводит к уменьшению этого времени. В латентном периоде токсины необратимо связываются с нервными терминалиями. Попытка в условиях эксперимента отмыть токсин от нервных окончаний биопрепарата не приводит к восстановлению способности проводить нервный импульс.
В паралитической стадии интоксикации с помощью электронно-микроскопических исследований удается выявить существенные нарушения структуры пресинаптических отделов холинэргических синапсов. Отмечается набухание митохондрий и их разрушение, значительное уменьшение числа синаптических везикул, уплотнение аксоплазмы.
Механизм действия токсинов до конца не выяснен. Полагают, что нейротоксические фосфолипазы специфически связываются с определенными сайтами пресинаптической мембраны, а затем вызывают неспецифическое разрушение фосфоглицеридов мембраны вокруг сайта, инактивируя тем самым важные в функциональном плане структуры синапса. Опыты, выполненные на изолированных синаптосомах указывают, что одной из таких структур может являться система эффлюкса Са2+ в клетку и клеточные органеллы или каналы для других ионов, в частности К+. Полагают также, что для реализации токсического действия токсины должны попасть внутрь нервных терминалий с помощью механизма специфического эндоцитоза, где и вызывают повреждение синаптосом и митохондрий, нормальная функциональная активность которых необходима для экзоцитоза ацетилхолина. Поскольку нетоксичные фосфолипазы А2 неспецифически связываются с фосфоглицеридами любых, в том числе и несинаптических, биологических мембран, они не обладают свойствами нейротоксикантов.
Различные токсины, вероятно, связываются с различными сайтами пресинаптических структур. Так, одновременная инкубация биопрепарата с двумя нейротоксическими фосфолипазами А2 вызывает блок проведения импульса со значительно большей скоростью, чем с двойной дозой каждого из нейротоксинов в отдельности.
За исключением
 -бунгаротоксина рассматриваемые нейротоксины обладают также миотоксическим действием на скелетную мускулатуру млекопитающих. Внутримышечное введение веществ сопровождается острой некротической миопатией в области инъекции.
-бунгаротоксина рассматриваемые нейротоксины обладают также миотоксическим действием на скелетную мускулатуру млекопитающих. Внутримышечное введение веществ сопровождается острой некротической миопатией в области инъекции.В настоящее время бунгаротоксин, кротоксин, тайпоксин широко используются в практике лабораторных исследований физиологии и биохимии синапсов.
Ботулотоксин
Ботулотоксин - белок, продуцируемый микроорганизмами Clostridium botulinum. Эти бактерии развиваются в белковой среде (в анаэробных условиях) и порой являются причиной массовых пищевых отравлений, при использовании испорченных консервов, копченостей, грибов и т.д. (ботулизм). Ботулотоксин - табельное отравляющее вещество армии США.
В настоящее время известно более 8 серологических типов токсина: A, B, C, D, E, F и т.д., близких по структуре и токсической активности. Ботулотоксин представляет собой протеины с молекулярной массой 150000, состоящие из двух субъединиц (МВ 100000 и 50000), не обладающие протеолитической, фосфолипазной или иной ферментативной активностью. Токсины выделены в кристаллической форме. В водных растворах частично гидролизуются, но токсичность раствора при этом не теряется. Вещество устойчиво к кипячению в течение часа.
Смертельная доза токсина для человека составляет около 5 нг/кг массы.
Вещество проникает в организм через желудочно-кишечный тракт с зараженной водой и пищей, а при применении его в виде аэрозоля и через органы дыхания.
При исследовании судьбы токсиканта в организме установлено, что он избирательно захватывается нервными терминалиями холинэргических волокон; часть введенного токсина путем ретроградного аксонального тока транспортируется в тела нервных клеток. Об этом свидетельствует, в частности, высокое содержание J125 в ипсилатеральных (но не контралатеральных) полусегментах спинного мозга экспериментальных животных после введения им яда, меченого изотопом.
Клиника ботулизма развивается спустя несколько часов после действия яда (до 36). Первые симптомы интоксикации, это сочетание вегетативных реакций (тошнота, рвота, слюнотечение) и признаков общего недомогания (головная боль, головокружение, боли в конечностях). Позже нарушается функция слюнных и потовых желез, аккомодация органа зрения, расширяются зрачки. Основным проявлением интоксикации является постепенно развивающийся паралич поперечно-полосатой мускулатуры. Процесс начинается с глазодвигательной группы мышц. Ранним признаком отравления является диплопия. Позже присоединяется паралич мышц глотки, пищевода (нарушение глотания) и других мышечных групп. Токсический процесс постепенно нарастает. Иногда лишь на 10 сутки и в более поздние сроки может наступить смерть от паралича дыхательной мускулатуры и асфиксии. Летальность при отравлении ботулотоксином составляет от 15 до 30%, а при несвоевременном оказании помощи (введение антиботулинической сыворотки, перевод пострадавшего на искусственную вентиляцию легких и т.д.) может достигать 90%.
Ботулотоксин избирательно блокирует высвобождение ацетилхолина в нервно-мышечных синапсах. В опытах in vitro установлено, что действие ботулотоксина приводит к угнетению как спонтанного, так и вызванного выброса нейромедиатора. Чувствительность постсинаптического рецептора к ацетилхолину не изменяется. Блокада передачи сигнала не сопровождается вмешательством токсиканта в процессы синтеза и хранения ацетилхолина. При исследованиях in vitro спонтанная и индуцируемая активность концевой пластинки нейрона снижается на 90% в течение 60 - 90 минут, после добавления в инкубационную среду токсина в концентрации 10-8 М. По расчетам, для блокады синапса достаточно 10 молекул токсина. Чем выше нервная активность, тем быстрее происходит развитие интоксикации. Морфологические изменения в пораженных синапсах не выявляются методами световой и электронной микроскопии.
Действие вещества продолжительно, до нескольких недель, и потому характер взаимодействия токсина с пресинаптическими структурами-мишенями можно рассматривать как необратимое. Полагают, что восстановление нормальной иннервации мышц происходит в результате формирования новых синаптических контактов.
Периоду клинических проявлений предшествует скрытый период, во время которого и происходит связывание токсиканта с нервными окончаниями. Выделяют четыре периода действия токсина на синапс:
- связывание с плазматической мембраной холинергических нервных окончаний;
- интернализации токсина путем эндоцитоза;
- проникновение в цитозоль синапса при участии pH-зависимой транслоказы;
- внутриклеточное расщепление токсина под влиянием метал-зависимых эндопротеаз с высвобождением действующей части белковой молекулы. Для некоторых серотипов токсина эти молекулы идентифицированы и обозначены как: SNAP-25 (серотип А), синаптобревин (серотип В), синтаксин (серотип С).
Молекулярный механизм действия токсина до настоящего времени не выяснен. Вероятно, в основе эффекта лежит нарушение токсином механизма взаимодействия синаптических везикул, в которых депонирован ацетилхолин, с аксолемой, - необходимый этап процесса Ca2+-зависимого экзоцитоза медиатора. Электрофизиологические исследования показывают, что в отличии от нормальной реакции нервно-мышечного синапса на повышение содержания кальция в инкубационной среде (дозо-зависимый выброс нейромедиатора), увеличение концентрации экстрацеллюлярного кальция с 2 до 16 мМ не приводит к усилению выброса ацетилхолина волокном, обработанным ботулотоксином. Совместное введение в инкубат Ca2+ (4 мМ и выше) и ионофора усиливает выброс ацетилхолина из нервных окончаний обработанных токсином.
Как in vitro, так и in vivo нервную передачу в синапсах временно нормализует 4-аминопиридин. При введении летальной дозы токсина экспериментальному животному, последующее назначение 4-аминопиридина отчасти восстанавливает двигательную активность животного на 1 - 2 часа. К сожалению, из-за высокой токсичности и кратковременности эффекта, 4-аминопиридин не может рассматриваться как эффективное противоядие.
4.1.4.2. Блокаторы ионных каналов
В строгом смысле слова вещества этой группы не относятся к "чистым" нейротоксикантам, поскольку, блокируя ионные каналы, действуют на возбудимые мембраны всех типов клеток организма: нервных, мышечных, железистых. Порой не возможно решить, поражение какой из структур является ведущим в патогенезе острой интоксикации. Тем не менее, внешние признаки тяжелого поражения очень напоминают действие кураре, традиционно относимого к группе нейротоксикантов. И хотя механизм действия веществ совершенно иной, представляется целесообразным рассмотреть их свойства в данном разделе. Достаточно хорошо изученным представителями группы являются сакситоксин и тетродотоксин.
Сакситоксин
В 1957 году Schantz et al. удалось выделить и изучить свойства так называемого "паралитического яда моллюсков" - одного из наиболее токсичных веществ небелковой природы. По названию одного из моллюсков, употребляемых в пищу, из ткани которого токсикант также выделялся (Saxidomus), вещество получило название сакситоксин. Позже было установлено, что в организм моллюсков сакситоксин поступает с одноклеточными животными вида Conyaulax catenella, являющимися для них продуктом питания. Целый ряд моллюсков, съедобных в обычных условиях, в случае массового размножения этих простейших, в больших количествах накапливают в своих тканях токсин, который для них практически безвреден, становясь ядовитыми.
Сине-зелёные водоросли пресноводных водоемов также синтезируют сакситоксин. Имели место случаи отравления скота водой, зараженной этими водорослями.
Пути биосинтеза сакситоксина в организме одноклеточных не изучены. Установлено, что количество вырабатываемого вещества колеблется в очень широких пределах и зависит от географического региона, времени года и других условий.
Сакситоксин (МВ - 372) - аморфный, хорошо растворимый в воде, спирте, метаноле, ацетоне порошок. В 60х - 70х годах свойства сакситоксина активно изучались военным ведомством США. Химическое строение представлено на рисунке 18. Молекулы сакситоксина, выделенные из разных источников, не полностью идентичны.
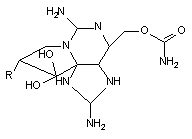
Рисунок 18. Структура молекулы сакситоксина
Смертельная доза сакситоксина для человека составляет по разным данным 0,004 - 0,01 мг/кг. Токсичность для мышей при внутрибрюшинном способе введения - около 9 мкг/кг (с регистрацией гибели в течение 30 минут). При назначении вещества через рот смертельная доза - 260 мкг/кг.
Вещество быстро абсорбируется в кишечнике и столь же быстро выводится из организма с мочой. Детально токсикокинетика токсиканта не изучена. Дискуссионным остается вопрос о способности вещества проникать через гематоэнцефалический барьер.
Выделяют три варианта течения отравления сакситоксином: гастро-энтеральный, аллергический, паралитический. Аллергическая (эритематозная) форма отравления появляется у отдельных лиц с повышенной чувствительностью к токсину. Типичной является паралитическая форма.
Обычно симптомы появляются в течение 30 минут после поступления вещества в организм. Первыми признаками поражения являются парестезии в области рта, губ, языка, десен, распространяющиеся на область шеи, конечности. Ощущение покалывания, жжения сменяются онемением. Позже присоединяется атаксия, возникает ощущение невесомости тела. При тяжелой интоксикации появляются признаки бульбарных нарушений: затруднение глотания, речи (иногда - афония), изменение ширины зрачка, временное нарушение зрения. Частыми проявлениями отравления являются: понос, рвота, тошнота, потливость, головная боль, слабость мускулатуры, тахикардия, чувство жажды, саливация, анурия, боли в животе. Паралич двигательной мускулатуры, начавшись в области конечностей, распространяется на другие группы мышц. Смерть наступает через 1 - 24 часа от паралича дыхательной мускулатуры и асфиксии.
Специфических средств терапии нет. Целесообразно перевести пострадавшего на искусственную вентиляцию легких. В случае сохранения жизни прогноз благоприятный: выздоровление бывает быстрым и полным.
Место токсического действия сакситоксина - возбудимые мембраны нервных клеток и миоцитов, причем до конца не определено, какие из структур являются более чувствительными. В опытах на анестезированных кошках показано, что при введение вещества в смертельной доза, проведение нервных импульсов по диафрагмальному нерву регистрируются, когда электромиограмма диафрагмальной мышцы уже безмолвствует. Развивающееся снижение артериального давления связывают с блокадой проведения нервных импульсов по симпатическим нервным волокнам, параличом гладкомышечных клеток сосудистой стенки. Сердечная мышца вовлекается в процесс при введении токсиканта лабораторным животным в дозе 7 мкг/кг.
Токсический эффект на возбудимые мембраны сакситоксин оказывает только при экстрацеллюлярной аппликации. Установлено, что вещество образует обратимый комплекс с белками электровозбудимых натриевых каналов мембран, полностью блокируя при этом вхождение иона внутрь клетки. Тем самым подавляется генерация потенциала действия. Полагают, что взаимодействие осуществляется за счет группы гуанидина, содержащейся в структуре токсиканта.
Тетродртоксин
Тетродотоксин обнаружен в тканях целого ряда живых существ, среди которых рыбы (более 70 видов, в том числе семейства Tetrodontidae - четырехзубообразные), лягушки (3 вида), моллюски (1 вид). В Японии, где представитель четырехзубообразных, рыба Фугу, является деликатесом, десятки людей ежегодно отравляются в результате неумелого приготовления блюда.
Вещество выделено в чистом виде, структура его изучена (рисунок 19). Это бесцветный порошок хорошо растворимый в воде. Раствор стабилен при комнатной температуре. Молекулярная масса - 319,3.
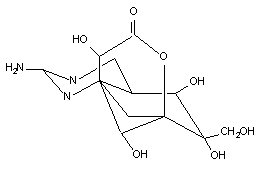
Рисунок 19. Структура молекулы тетродотоксина
Токсичность вещества для белых мышей при внутрибрюшинном способе введения около 10 мкг/кг массы. Доза в 5 мкг/кг (подкожно) вызывает у собак рвоту и нарушение дыхания, а дозы более 6 мкг/кг в течение час приводят к гибели в результате прекращения дыхания и асфиксии.
Независимо от способа поступления в организм симптомы отравления практически одинаковы. Спустя 10 - 45 минут появляется тошнота, рвота, боли в животе, понос, парестезии губ, языка, слизистой полости рта. Покалывание, ощущение жжения кожи конечностей - ранние признаки развивающегося паралича. Позже развивается бледность кожных покровов, беспокойство, общая слабость, онемение конечностей. Зрачок сначала сужен, затем расширяется; в тяжелых случаях взгляд фиксирован, зрачковый и корнеальный рефлексы отсутствуют, нарастают брадикардия и гипотензия, отмечаются гиперсаливация, профузная потливость, понижение температуры тела. Дыхание учащается, становится поверхностным, развивается цианоз губ и конечностей. Иногда на коже и слизистых образуются пузыри. Двигательные расстройства проявляются все отчетливее: появляются подергивания отдельных групп мышц, тремор, координация движений нарушается. Относительно рано в процесс вовлекаются мышцы гортани и глотки, развивается афония. Сознание, как правило, сохраняется весь период интоксикации. Постепенно развивающийся паралич охватывает все большие группы мышц. Смерть наступает от паралича дыхательной мускулатуры и асфиксии в течение 6 - 24 часов от начала интоксикации. Если больной выживает в течение последующих суток, наступает практически полная нормализация состояния, как правило, без отдаленных последствий. Специфических противоядий нет. Рекомендуется перевод пострадавшего на искусственное дыхание.
Исчерпывающих данных о причинах развивающихся эффектов нет. Так, по мнению одних исследователей остановка дыхания является следствием действия токсина на нейроны дыхательного центра, другие полагают, что основным является нарушение проведения нервного импульса по дыхательным нервам или возбудимости дыхательных мышц. Вероятно, последнее представление справедливо, поскольку электровозбудимость диафрагмы блокируется меньшими дозами токсиканта, чем проведение нервного импульса по диафрагмальному нерву.
Показано, что гипотензивное действие тетродотоксина может быть обусловлено прогрессивным параличом мышц кровеносных сосудов и нарушением распространения нервного импульса по вазомоторным нервам.
Многие явления (атаксия, головокружение, нарушение речи) могут быть связаны с действием вещества на нейроны ЦНС.
Тетродотоксин, как и сакситоксин, оказывает избирательное действие на возбудимые мембраны нервов и мышц. Вещество действует только с внешней стороны клетки, полностью блокируя проникновение ионов Na+ внутрь клетки, что совершенно необходимо для формирования потенциала действия. Полагают, что одна молекула тетродотоксина полностью блокирует один ионный канал. Взаимодействие токсина с белками ионных каналов обратимо. Токсикант in vitro может быть удален с поверхности возбудимой мембраны простым отмыванием препарата.
4.2. Хронические нейротоксические процессы. Токсические нейропатии
Хронические процессы, развивающиеся со стороны нервной системы в результате острого, подострого или хронического воздействия токсикантов можно классифицировать в соответствии с повреждаемыми элементами нервной системы, характером повреждения нервных образований и механизмами, лежащими в основе патологии. Наиболее удобна морфологическая классификация (таблица 23).
Таблица 23. Характеристика хронических нейротоксических процессов
Тип |
Поражаемая структура |
Патологическая реакция |
Признаки |
Примеры |
1. |
Тела нервных клеток |
Гибель нервных клеток (токсическая нейронопатия) |
Быстрое начало, часто исключительно нарушение чувствительности |
Метилртуть Адриамицин Талий Тетраэтил- свинец |
2. |
Миелиновая оболочка |
Сегментарная демиелинизация (токсическая миелинопатия) |
Быстрое начало, преимущественно моторные нарушения |
Теллур Триэтил-олово Гексахлор-фенол |
3. |
Аксон |
Аксональная дегенерация (дистальная аксонопатия) |
Постепенное начало, моторно-сесорные нарушения, симптомы "носков и перчаток" |
ТОКФ Акриламид Ароматические углеводороды |
Частыми формами хронического процесса являются токсические нейропатии. Однако весьма ограниченное количество веществ избирательно действует на периферические отделы нервной системы. Большинство повреждает и структуры ЦНС, поэтому токсическим нейропатиям не редко сопутствуют признаки энцефалопатии.
В основе хронических процессов, как правило, лежат нарушения пластического обмена в нервной системе, сопровождающиеся её структурно-морфологическими изменениями. Механизмы действия токсикантов, благодаря которым они вызывают нарушение пластического обмена, многообразны и малоизученны. Многообразие механизмов отражается в особенностях течения заболеваний. Так, при хронической интоксикации свинцом, в клинике преобладают признаки моторных нарушений. Трихлорэтилен вызывает поражение тройничного и лицевого нервов, сочетающееся с церебральной патологией. Хроническое отравление мышьяком сопровождается полиневропатией с выраженным болевым синдромом. Фосфорорганические инсектициды могут вызвать отсроченную нейропатию (скрытый период: 1 - 3 недели и более).
Однако, не смотря на различия механизмов поражения, и целый ряд особенностей течения патологии, проявления токсического процесса как правило близки и в большей степени зависят не от механизма действия токсикантов, а от анатомического образования, на которое они подействовали. Очень часто процесс прогрессирует и после прекращения действия токсиканта.
Токсические нейропатии проявляются сегментарной демиелинизацией (токсической миелинопатией) и аксональной дегенерацией (токсической дистальной аксонопатией) (таблицы 23).
Основные признаки этих форм патологии представлены на таблице 24.
Таблица 24. Признаки периферических нейропатий
Сегментарная демиелинизация |
Аксональная дегенерация |
- деструкция миелиновой оболочки; - вторичное поражение нервного волокна; - снижение скорости проведения нервного импульса; - возможна относительно быстрая полная регенерация |
- дистальная дегенерация аксона; - вторичная дегенерация миелиновой оболочки; - на ранних стадиях скорость проведения нервного импульса в пределах нормы, но снижена амплитуда потенциала действия; - денервация мышечных групп; - восстановление медленное и неполное |
Очень многие токсиканты вызывают смешанную форму хронического нейротоксического процесса.
4.2.1. Токсическая сегментарная миелинопатия
Миелинобразующие клетки весьма уязвимы для действия токсикантов, поскольку обладают большой площадью поверхности и объёмом цитоплазмы, в котором необходимо поддерживать определённый уровень обменных процессов.
Ключевыми характеристиками сегментарной миелинопатии являются: преимущественное поражение отростков миелинобразующих клеток и малая чувствительность к действию токсикантов перикариона клеток Шванна; более существенное повреждение нервных волокон с большим диаметром и большими промежутками между перехватами Ранвье; более раннее повреждение дистальных отделов нервных стволов; хорошая способность к регенерации повреждений и относительно быстрая ремиелинизация волокон, проходящая даже в период продолжающейся аппликации токсиканта при его хроническом воздействии.
При интоксикациях некоторыми веществами (ацетилэтил-тетраметил-тетралин - АЭТТ, триэтилово, изониазид и др.) нарушения отмечаются не только в периферических нервных стволах, но и в ЦНС.
4.2.2. Токсическая дистальная аксонопатия
Дистальная аксонопатия - наиболее частая форма поражения периферического отдела нервной системы токсикантами. До настоящего времени этот вид патологии и в эксперименте и в клинических условиях изучен недостаточно глубоко.
Перечень некоторых веществ, способных вызывать токсические аксонопатии у человека представлены на таблице 25.
Таблица 25. Вещества, вызывающие токсические аксонопатии у человека
Лекарства |
Пестициды |
Производственные токсиканты |
амитриптилин амфетамин дапсон дифенилгидантион дисульфирам винбластин винкристин изониазид нитрофурантион пенициллин хлорамфеникол хлорохин цисплатин |
ДДТ диэльдрин динитрофенол монобромметан петахлорфенол полисульфид бария ФОИ (карбафос, дихлофос, лептофос и др.) |
акриламид бензол гексан гидразин дихлорбензол метилбромид метилбутилкетон мышьяк галогенированные бифенилы свинец сероуглерод талий ТОКФ тетрахлорэтан трихлорэтилен четыреххлористый углерод этиленоксид |
В большинстве случаев проявления отравлений мало специфичны и характеризуются знаками симметричной сенсомоторной полинейропатии. При электронной микроскопии пораженных нервов выявляется скопление нейрофиламентов в областях локализации перехватов Ранвье.
Патологические изменения первоначально формируются в виде мультифокальных поражений дистальных отделов длинных миелинезированных аксонов большого диаметра (мотонейроны). Особенно уязвимы волокна сидалищного нерва и в частности проводники, иннервирующие икроножные мышцы. Поскольку первоначально в процесс вовлекаются лишь дистальные отделы нервных волокон, пострадавший в течение некоторого времени может полностью сохранять работоспособность. Дегенеративные изменения аксона постепенно распространяются проксимально в сторону тела нервной клетки. Нарастает слабость соответствующих групп мышц. Так как мотонейроны поражаются диффузно, и в структуре нервного ствола сохраняется большое число интактных волокон, не смотря на выраженную клинику интоксикации, скорость проведения импульса по нерву изменяется мало. Аксональные нейропатии, как правило, сопровождаются вторичной демиелинизацией нервных стволов.
Нарушение чувствительности также отмечается первоначально в дистальных отделах конечностей. Это проявляется потерей чувствительности в области кистей и стоп (симптом "носков и перчаток"). Постепенно в процесс могут вовлекаться и нейроны чувствительных ганглиев задних корешков спинного мозга.
Поражения вегетативных волокон встречаются крайне редко.
Последовательность событий, развивающихся при формировании токсических нейропатий, достаточно типична. Характерны: периодически возникающее чувство онемения конечностей; повышение болевой чувствительности кожных покровов дистальных отделов конечностей; болезненность по ходу нервов верхних и нижних конечностей; парестезии; слабость мышечных групп, развивающаяся от периферии к центру, преимущественно разгибателей; атаксия; атрофия мышц конечностей.
Регенерация аксона (в отличии от ремиелинизации) проходит медленно со скоростью около 1 мм в сутки. В этой связи процесс восстановления затягивается на месяцы, и даже годы.
Многие токсиканты повреждают не только периферические, но и центральные нервные проводники. В ЦНС также страдают структуры, образованные длинными аксонами большого диаметра: кортикоспинальный, спиноцеребеллярный тракты. Проводящие пути, образуемые короткими отростками малого диаметра (оптический нерв), вовлекаются в патологический процесс в последнюю очередь, и, как правило, лишь при хронических интоксикациях. Нарушения в ЦНС и ПНС могут формироваться практически одновременно, при этом центральные эффекты часто маскируются более выраженными периферическими эффектами. Однако после восстановления функций периферических нервных стволов могут выявляться признаки поражения ЦНС: спастичность, атаксия, атрофия оптического нерва, нарушение умственных способностей.
Интимные механизмы действия большинства токсикантов не известны. Отмечается, что вещества, способные вызывать аксональную дегенерацию, угнетают активность таких ферментов, как нейрэстераза (см. ниже), а также глицеральдегид-3-фосфат дегидрогеназа, необходимых для обеспечения энергетических и пластических процессов в нервной клетке.
Три-О-крезилфосфат (ТОКФ)
Классическим представителем веществ, вызывающих дистальную аксонопатию является три-О-крезилфосфат (рисунок 20). Это маслянистая жидкость, хорошо растворяющаяся в липидах и органических растворителях. Вещество широко используется в качестве термостабильной добавки к машинным маслам и пластификатора при производстве пластмасс. ТОКФ относится к группе ФОС, но антихолинэстеразным действием не обладает.
Рисунок 20. Структура молекулы три-О-крезилфосфата
Отчетливая картина интоксикации развивается при приёме внутрь около 120 мг ТОКФ (т.е. 2 мг/ кг массы). Анализ показывает, патология различной степени тяжести может развиваться и от значительно меньших доз вещества (более 0,5 мг). В 1940 году 89 солдат Шведской армии получили отравление ТОКФ, в результате использования в пищу масла, контаминированного токсикантом. Клиника отравления у всех пострадавших была сходной. Спустя 1 - 12 часов развились признаки гастроэнтерита, характеризующиеся рвотой (90%), болями в области живота, поносом. Явления продолжались в течение 24 - 36 часов. Затем, после латентного периода продолжавшегося 13 - 27 суток появились парестезии, а потом и вялые парезы дистальных групп мышц нижних конечностей (сначала разгибателей). Позже присоединились явления слабости мышц верхних конечностей (46%), бедер (41%), области таза (43%). Нарушение сухожильных рефлексов отмечалось у всех пострадавших (коленный рефлекс, ахилов рефлекс). Чувствительные и черепно-мозговые нервы в патологический процесс вовлечены не были. У 26% пострадавших отмечено нарушение вегетативных функций: парез мочевого пузыря, импотенция. Проявления интоксикации достигли максимума к 3 - 4 неделе заболевания. Затем наступила ремиссия, однако через три месяца от начала интоксикации появились признаки нарушения ЦНС: спастичность и атаксия. У 52 пораженных полного восстановления функций не произошло.
В эксперименте установлено, что в основе патологического процесса лежат выраженные морфологические нарушения отдельных нервных волокон. Они характеризуются появлением участков дегенерации по ходу аксонов. Демиелинизация волокон не отмечается. При электронной микроскопии пораженных участков нервного волокна выявляется дезинтеграция нейрофиламентов, скопление мембранных и гранулярных патологических включений. Отмечаются морфологические нарушения в синапсах передних рогов спинного мозга, характеризующиеся набуханием и разрывами везикулярных мембран. Полагают, что повреждение внутриклеточных мембран нейронов обусловлено взаимодействием ТОКФ с мембран-связанной нейрэстеразой, участвующей в их образовании. Необходимым условием развития нейропатии является существенное (около 80%), необратимое ингибирование энзима.
4.2.3. Перикариальная токсическая нейронопатия
Количество токсикантов, вызывающих повреждение перикариона нервных клеток, относительно невелико. К их числу относятся: метилртуть, ртуть, адриамицин, талидомид, алюминий, винкристин, сероуглерод, трихлорэтилен, тетраэтилсвинец (ТЭС) и др. Периферические нейропатии, вызываемые этими веществами, как правило, сопровождаются признаками поражения мозга, а для некоторых токсикантов именно центральное действие является основным (ТЭС).
Метилртуть
Благодаря высокой растворимости в липидах, метилртуть легко проникает через гистогематические барьеры и клеточные мембраны. Связь ртути с метильными радикалами достаточно прочна и поэтому значительная часть вещества выводится из организма в неизменённом виде. Поскольку выделение с мочой затруднено, а выводящееся с желчью вещество подвергается частичной реабсорбции в кишечнике, период его полувыведения продолжителен и у человека может достигать 200 суток.
Первые упоминания о массовых отравления метилртутью относятся к 1914 году, когда препарат стали использовать в качестве фунгицида для обработки семенного зерна. Источником метилртути в окружающей среде может стать биотрансформация неорганических соединений ртути биотой. Так, трагедия Минамата была связана с загрязнением неорганической ртутью прибрежных морских вод Японского моря. В результате биопревращений её планктоном образовывалась метилртуть, накопившаяся затем в большом количестве в тканях промысловых рыб. Использование зараженной рыбы в пищу привело к массовому отравлению людей.
Однако самой масштабной была трагедия в Иране, где население использовало в пищу продукты, приготовленные из зерна, обработанного фунгицидом. Число жертв исчислялось тысячами.
Метилртуть вызывает очаговую дегенерацию нейронов гранулярного слоя мозжечка и коры головного мозга, особенно зрительных областей. Первичные сенсорные нейроны также вовлекаются в патологический процесс.
Патология нервной системы, вызываемая метилртутью, изучена в опытах на экспериментальных животных. Установлено, что введение вещества крысам в дозе 7,5 мг/ кг в течение 8 дней приводит к поражению тел нейронов дорзальных ганглиев. При микроскопии уже на вторые сутки выявляется дегрануляция шероховатого эндоплазматического ретикулума в периферических отделах цитоплазмы пораженных нейронов. С увеличением дозы усиливается выраженность выявляемых изменений. К 8 суткам появляются отчетливые признаки дегенерации нейронов. Определяется фрагментоз нервных волокон на всём их протяжении. Поражаются волокна, формирующие как нервные стволы, так и проводящие пути спинного мозга. Причем деструктивные процессы захватывают как задние, так и передние отделы. Выявляемые признаки аксональной дегенерации, в настоящее время, рассматриваются как вторичные проявления нейронопатии. Поражение крупных ганглионарных клеток метилртутью объясняют быстрым накоплением вещества именно в этих нервных структурах, вследствие высокой проницаемости гематоневрального барьера в ганглиях задних корешков спинного мозга.
В опытах на кроликах (7,5 мг/ кг в течение 4 дней), помимо указанных, удаётся выявить изменения со стороны и других структур ЦНС. Так, определяются структурные изменения звёздчатых и корзинчатых клеток молекулярного слоя коры мозжечка, нейронов 2,3,4 слоев теменной и затылочной областей коры головного мозга. Морфологическим субстратом повреждения нервных клеток является дегрануляция и разрушение шероховатого эндоплазматического ретикулума. Характерная особенность нервных клеток ЦНС, чувствительных к метилртути - малые размеры, большой объём ядра клетки. Будучи цитоплазматическим ядом, вещество в большей степени поражает клетки с тонким слоем цитоплазмы
В ходе биохимических исследований удалось показать, что метилртуть - рибосомальный яд. Под влиянием токсиканта нарушается включение меченых аминокислот в структуру синтезируемых нервными клетками белков. Вещество характеризуется высоким сродством к SH-группам. Из 120 рибосомальных сульфгидрильных групп примерно половина имеет функциональное значение для реализации процесса белкового синтеза. Находясь в активном состоянии, эти группы наиболее активно вступают во взаимодействие с токсикантом.
Тетраэтилсвинец
Тетраэтилсвинец (ТЭС) - Pb(C2H5)4 - маслянистая летучая жидкость, практически не растворимая в воде, но хорошо растворяющаяся в жирах и органических растворителях. ТЭС используют, как антидетонатор, добавляемый в составе этиловой жидкости к некоторым сортам бензина. Вещество может проникать в организм ингаляционно и через неповрежденную кожу, а также с продовольствием, контаминированным токсикантом. В течение 3 - 4 суток ТЭС в неизмененном виде обнаруживается в крови и тканях. В результате метаболизма в печени и других тканях ТЭС превращается в триэтилсвинец, с образованием которого и связывают развитие патологии. Триэтилсвинец длительно (до 20 суток) циркулирует в крови, постепенно накапливаясь в печени и ЦНС. Наибольшее количество вещества депонируется в таламусе, гипоталамусе, стриатуме, фронтальных отделах коры больших полушарий мозга - структурах, плотно иннервируемых дофаминергическими нервными окончаниями. В дальнейшем вещество разрушается до неорганического свинца, который частично откладывается в тканях, а частично выводится с мочой и калом.
Контакт ТЭС с покровными тканями, как правило, проходит незамеченным, поскольку вещество не обладает раздражающим или прижигающим действием. Проявления поражения развивается после скрытого периода, который продолжается от нескольких часов до 10 суток. Наиболее ранними признаками поражения являются гипотония, гипотермия, брадикардия, повышенная потливость, саливация, головокружение - проявления повреждений высших центров регуляции вегетативного отдела нервной системы. Постепенно состояние ухудшается, появляются иллюзии (извращение вкуса), галлюцинации - зрительные, слуховые, тактильные (ощущение инородного тела во рту), депрессия, тревожный сон с кошмарными сновидениями. При тяжелых интоксикациях отмечается: расстройства речи, шаткая походка, нистагм, гиперрефлексия, птоз, дрожание век, языка, пальцев рук, парез лицевого нерва, нарушение интеллекта, резкое психомоторное возбуждение, бред. На высоте интоксикации возможна смерть от остановки сердечной деятельности. В благоприятных случаях выздоровление наступает через 2 - 3 месяца, но редко бывает полным. Как правило, явления энцефалопатии отмечаются в течение длительного времени.
Механизм токсического действия ТЭС до конца не выяснен. Полагают, что в основе токсического процесса лежит нарушение пластического обмена в клетках мозга, обусловленное ковалентным связыванием свинца с биомолекулами, в состав которых входят амино-, карбокси-, имидазол-, фосфатные и SH-группы. Результатом такого взаимодействия является денатурация молекул, нарушение их свойств и функций. Свинец конкурирует с двухвалентными металлами, такими как Ca2+ и Zn2+. В итоге угнетается активность большого количества энзимов (аденилатциклазы, Na-K-АТФазы), нарушается синтез белка в клетках, повреждаются процессы, проходящие в митохондриях (угнетение окисления жирных кислот, декарбоксилирования пировиноградной кислоты, снижаются запасы макроэрогов) и т.д. Существенно страдает обмен дофамина в ЦНС: увеличивается потребление тирозина, усиливается выброс дофамина, нарушается обратный захват нейромедиатора. Это указывает на серьёзное повреждение дофаминэргических медиаторных структур мозга. При тяжелых интоксикациях происходит гибель нервных клеток, что лежит в основе органического синдрома поражения мозга.
Алюминий
Алюминий чрезвычайно широко распространённый элемент. Контакт с ним человека неизбежен. Вместе с тем случаи острой или хронической интоксикации веществом неизвестны. Это связано с неспособностью алюминия проникать через барьеры, образованные кожей, эпителием желудочно-кишечного тракта и легкими.
Однако в особых условиях возможна интоксикация алюминием. Так, в литературе описан случай энцефалопатии, сопровождавшийся повышением содержания алюминия в ткани головного мозга у больного, длительно находившегося на гемодиализе. Для контроля уровня фосфатов в плазме крови использовали алюминий-содержащий гель.
Увеличение содержания алюминия в ткани мозга обнаружено у лиц с болезнью Альцгеймера. Необходимы дальнейшие наблюдения и исследования установления роли алюминия в патологии мозга.
Алюминий вызывает специфические изменения нейрофибрил нейронов. Впервые эффект был установлен при интрацеребральном введении кролику антигена, связанного с адъювантом, содержащим фосфат алюминия. При поражениях изменённые нейроны обнаруживаются практических во всех структурах мозга. При электронной микроскопии в поврежденных нервных клетках регистрируются участки локального просветления цитоплазмы, представляющие собой конгломерат нейрофиламентов. В эксперименте изменения нейронов удаётся воспроизвести и при подкожном введении животному больших доз солей алюминия.
Таллий
Основные источники загрязнения окружающей среды таллием - цементные заводы, теплоэлектростанции (ТЭС), работающие на угле, плавильные комбинаты, по выпуску меди, цинка, кадмия и свинца. Вода может быть заражена таллием близ металлоплавильных производств. В атмосфере таллий может присутствовать в форме металла, а также оксида и сульфата. Основное производство, использующее таллий - выпуск полупроводников и электрических переключательных устройств.
В 1920 г. в Германии соли таллия начали применять в качестве пестицидов. Действующий агент содержал 2% сульфата таллия. Стойкость вещества в окружающей среде и кумуляция в организме млекопитающих сделали его идеальным родентицидом. Именно в качестве пестицида таллий стал причиной отравления человека. В 1965 году использование таллия в качестве пестицида в США было запрещено, однако в других странах мира он продолжает использоваться с этой целью. Таллий также применяют для изготовления оптических линз, красителей, пигментов, фейерверка. Таллий стал важнейшим веществом в производстве сверхпроводников.
В развитых странах основные области потребления таллия - это производство электроники, фотоэлектрических элементов, ламп, сцинтилляционных счетчиков, полупроводников. Вещество также используют, как катализатор в химическом синтезе, в производстве сверхпроводников, искусственных ювелирных изделий.
Новая волна широкого использования таллия в качестве сверхпроводника и катализатора, заставляет внимательно изучать токсичность вещества.
Основной причиной легких отравлений таллием является ингаляция воздуха, содержащего таллий или потребление фруктов, обработанных этим веществом. Поскольку метал обладает выраженными кумулятивными свойствами и абсорбируется через кожу (также как и ЖКТ), необходимо учитывать свойства этого вещества, как потенциального экотоксиканта.
Острые тяжелые отравления таллием, как правило, являются следствием случайного или преднамеренного приема солей металла per os. На производстве возможны также ингаляционные воздействия и действие при попадании на кожу. Всасывание вещества осуществляется быстро (в течение 1 часа) и практически полностью (в опытах на грызунах - до 100%). Соединения таллия в руках неопытного и не проинструктированного человека представляют большую опасность.
После проникновения в кровь таллий распространяется по организму, проникая внутрь клеток. Наибольшее количество металла скапливается в почках (в медулярном слое). Высокое содержание металла определяется в сердечной мышце, печени и волосах. Концентрация таллия в жировой ткани и мозге низкая. В крови металл равномерно распределяется между плазмой, лимфоцитами и эритроцитами. Таллий проникает через плаценту, однако содержание его в тканях плода - незначительно.
Основные пути выделения таллия - через почки и ЖКТ. Период полувыведения из организма человека составляет около 30 суток.
Таллий - сильный нейротоксикант. Как правило, клинические проявления острой интоксикации нарастают медленно в течение нескольких недель и характеризуются развитием острых и подострых эффектов (таблица 26).
Таблица 26. Основные проявления интоксикации таллием
1. Острые эффекты: - Тошнота - Рвота - Боли в животе - Тремор - Мышечная атрофия - Параличи - Атаксия - Психоз - Судороги - Кома 2. Подострые эффекты: - Запоры - Желудочно-кишечные кровотечения - Дерматит (эритема, изменение ногтей, шелушение кожи, линии Мии) - Парестезия - Восходящая нейропатия - Полиневрит - Мышечная слабость - Нейропатия черепно-мозговых нервов (птоз, офтальмоплегия, ретробульбарный неврит, неврит лицевого нерва) - Атаксия - Утомляемость - Эмоциональные нарушения - Психозы |
При пероральном отравлении первые симптомы - тошнота и рвота. Затем, в течение последующих 7-14 дней развиваются боли в животе, запоры, ощущение тяжести в желудке, кровотечение.
Неврологические симптомы, как правило, появляются через неделю и характеризуются невритами, преимущественно нижних конечностей. Через 1-3 недели после воздействия болезненность по ходу нервов усиливается, развивается атаксия, тремор. Мышечные рефлексы сохраняются обычно достаточно долго. В процесс вовлекаются краниальные нервы.
Поражение блуждающего нерва сопровождается тахикардией, умеренной гипертензией, парезом кишечника. Нарушения, выявляемые при электрокардиографии, напоминают состояние гипокалиемии.
Психические расстройства проявляются депрессией и психозом.
При тяжелых интоксикациях довольно быстро развиваются галлюцинации, делирий, судороги, кома. Смерть развивается в результате нарушений сердечной деятельности и функций почек.
Выздоровление происходит медленно и растягивается на месяцы.
При хроническом воздействии, как правило, развивается стойкая нейропатия, сопровождающаяся слабостью мышц нижних конечностей, болезненностью по ходу нервов, нарушениями интеллекта, потерей волос. Аллопеция может развиваться спустя месяцы после воздействия таллием. Восстановление растягивается на многие месяцы.
Механизм действия вещества изучен недостаточно. Известно, что таллий и калий конкурируют за механизмы переноса ионов через биологические мембраны, опосредованные активностью Na-K-АТФазы. Таллий может замещать К+ и выступать его конкурентом и в других жизненно-важных процессах.
В настоящее время отсутствуют эффективное лечение отравлений таллием. В опытах на животных известной активностью обладали диэтилдитиокарбамат (дитиокарб) и дифенилтиокарбазон (дитизон). Однако использование этих комплексонов у людей выявили их слабую эффективность.
Рекомендуют сочетанное применение хлористого калия с активированным углем. Калий вытесняет Tl из связи с внутриклеточными рецепторами. Рекомендуют дополнять терапию назначением прусского голубого (ферроцианоферрат калия). Препарат назначают per os в дозе 250 мг/кг в сутки в 50 мл 15% маннитола в два приема (применяли до 10 грамм два раза в день). Прусский голубой не всасывается в ЖКТ. Калий, вытесняет Tl, а последний связывается с ферроцианоферратом и выводится из организма.
Адриамицин
Адриамицин - используется в клинической практике как цитостатик. Вещество известно, как нейротоксикант, селективно повреждающий нейроны ганглиев дорзальных корешков спинного мозга и симпатические нейроны. Вещество связывается с ДНК нейронов, нарушает синтез РНК. Опыты с введением меченного 3Н-лейцина экспериментальным животным показывают существенное замедление процесса его ассимиляции нервными клетками, что указывает на нарушение процессов синтеза белка.
Нейротоксический эффект получен только в эксперименте при одномоментном введении большой дозы препарата. При интоксикации выявляются дегенеративные изменения периферических нервов, дорзальных корешков и дорзальных колонн спинного мозга. При микроскопии определяются деструктивные изменения в телах нейронов, состоящие в смещении ядра клетки, увеличении числа цитоплазматических нейрофиламентов, образовании мембрансвязанных полостей.
Избирательное повреждение нервных клеток симпатических ганглиев дорзальных корешков спинного мозга связано с высокой сосудистой проницаемостью этих регионов нервной системы. Гематоэнцефалический барьер не проницаем для этого вещества.
Винкристин
Винкристин - цитотоксический агент, используемый для лечения лейкемии и других неопластических процессов. Вскоре после введения препарата в клиническую практику была обнаружена его способность вызывать нейронопатии. В эксперименте на лабораторных животных эффект воспроизводится при внутрицеребральном введении вещества. При микроскопическом исследовании в поврежденных нейронах обнаруживаются скопления нейрофиламентов диаметром 9 - 10 нм. Цитотоксическое действие винкристина связывают с его способностью повреждать микротрубочки, формирующиеся в клетке в метафазе митоза. Вещество присоединяется к мономерам, из которых формируются микротрубочки, препятствуя процессу их полимеризации. В нервных клетках, как полагают, также происходит нарушение образования микротрубочек, имеющих важное значение для обеспечения аксонального тока пластических элементов цитоплазмы нейронов.
Однако не исключено, что механизм нейротоксического действия винкристина может быть и иным.
5. Оценка нейротоксичности в эксперименте
Современная нейробиология располагает огромным арсеналом прецизионных методов, позволяющих всесторонне оценить функциональное состояние нервной системы человека и экспериментальных животных. Многие из этих методов требуют высокой квалификации специалистов, дорогостоящего оборудования и применяются лишь в специальных токсикологических исследованиях. Однако, оценка нейротоксичности ксенобиотика может быть осуществлена и в ходе достаточно простых поведенческих, биохимических, электрофизиологических, патологоанатомических исследований.
Поведенческие исследования предполагают наблюдение за животными, подвергающимися острому, подострому, хроническому действию веществ, с целью выявления признаков нарушения вегетативных функций, рефлекторной деятельности, двигательной активности, координации движения, мышечного тонуса, стереотипий, возбуждения или угнетения ЦНС и т.д.
Если такие признаки выявляются и есть необходимость определить эффективные дозы, в которых вещество вызывает те или иные эффекты, и дать их детальную характеристику, возможно проведение специальных исследований, направленных на оценку условно-рефлекторной деятельности, этологических показателей и т.д. Электрофизиологические исследования позволяют уточнить механизмы нейротоксического действия исследуемого ксенобиотика.
Возможность химических веществ вызывать отсроченные нейропатии желательно оценивать в опытах на курах, у которых этот эффект достаточно легко выявляется, в отличие от обычных лабораторных животных (грызуны).
Биохимические исследования используют, прежде всего, при оценке токсичности новых инсектицидов из группы антихолинэстеразных веществ (ФОС и карбаматы). Активность холинэстеразы может определяться в цельной крови, плазме крови, эритроцитах и головном мозге экспериментальных животных.
Ингибиторная активность соединений в отношении так называемой нейрэстеразы может быть использована для оценки их способности вызывать отсроченные нейропатии.
К помощи морфологических (макроскопических и микроскопических) методов исследования структур головного мозга и ПНС прибегают в случае необходимости дать детальную характеристику процессов, развивающихся при действии оцениваемого токсиканта.
6. Диагностическая стратегия в нейротоксикологии
Диагностика выраженных нейротоксических эффектов не вызывает затруднений, поскольку формирующиеся при этом клинические синдромы достаточно хорошо изучены. Сложной задачей является выявление патологии у лиц со скудной клиникой поражения, отсутствием очевидных свидетельств контакта с нейротоксикантом. Тем не менее именно такие ситуации встречаются наиболее часто. В этих случаях возникает вопрос, являются ли выявляемые нарушения следствием химических воздействий или представляют собой идиопатические заболевания нервной системы. Диагностическая стратегия в подобных ситуациях включает сбор анамнеза, детальное обследование пострадавшего врачом-специалистом и выявление клинических синдромов, проведение специальных диагностических тестов.
6.1. Сбор анамнестических данных
Ключом к выявлению нейротоксических эффектов является правильный сбор анамнеза. Это связано с тем, что симптоматика при токсических нейропатиях как правило мало чем отличается от идиопатических заболеваний нервной системы. Сбор анамнеза должен быть направлен на установления возможных контактов пострадавшего с опасными веществами в быту и на производстве. Опрос не должен быть излишне подробным. Следует останавливаться на наиболее информативных моментах. Примерный перечень задаваемых вопросов представлен в таблице 27.
Таблица 27. Перечень вопросов, рассматриваемых при сборе данных профессионального анамнеза
1. Где работает пациент и как давно? 2. Какой вид продукции выпускается? 3. Каков характер деятельности пациента на производстве? 4. С какими токсикантами непосредственно контактирует пациент? 5. Каково агрегатное состояние этих токсикантов? 6. Были ли случаи воздействия высоких доз токсикантов? 7. Используются ли на рабочем месте индивидуальные средства защиты; какие? 8. Имеются ли на рабочем месте специальные устройства кондиционирования среды (вытяжные шкафы, вентиляция, дренажные устройства)? 9. Отмечается ли связь между ухудшением самочувствия и работой? 10. Были ли симптомы патологии до поступления на работу? 11. Появляются ли признаки заболевания в процессе работы, после работы, в выходные дни? 12. Наблюдаются ли аналогичные нарушения здоровья у коллег? |
В тех случаях, когда сбор анамнеза не позволяет прийти к определенному заключению, оправдано посещение врачом рабочего места пациента.
Если не удаётся выявить действующий агент на производстве, необходимо ознакомиться с бытовыми условиями, привычками, хобби пациента, так как и здесь может быть обнаружен потенциальный нейротоксикант. В окружающей среде можно найти самые разнообразные химические соединения, однако, их концентрация, как правило, совершенно недостаточна для инициации патологических процессов. Иногда регистрируются случаи массового заболевания людей в регионах, где имели место техногенные аварии на промышленных объектах с выбросом в окружающую среду больших количеств высокотоксичных веществ. Идентификация таких случаев не представляет большой трудности для экспертов.
6.2. Исследование специалистами
Симптомы интоксикации, по сути, идентичны проявлениям идиопатических форм патологии нервной системы. Обменные, инфекционные и другие факторы, вызывают патологические состояния, в основе которых, также как при действии химических веществ, лежит гибель нейронов или их дисфункция, аксональная дегенерация, диффузная демиелинизация и т.д.
Более того, один и тот же токсикант, как указывалось, может вызвать различные формы поражения нервной системы, и вместе с тем разные токсиканты могут провоцировать близкую симптоматику. Исследование специалиста, в этой связи, должно быть максимально тщательным и направлено на выявление всех характерных черт течения конкретного заболевания. Некоторые симптомокомплексы патогномоничны для токсических поражений. Так, дистальная аксонопатия, сочетающаяся с гастроэнтеритом и выпадением волос - частый признак отравления мышьяком и таллием; тремор конечностей в сочетании с опсоклонусом - как правило, признак начального периода интоксикации хлордеконом.
6.3. Функциональные исследования
Изучение нервной проводимости и электромиографические исследования хотя и не является специфичным для выявления токсических нейропатий, тем не менее дают важную количественную характеристику патологического процесса, позволяющую контролировать его динамику, а также дифференцировать аксональную дегенерацию от сегментарной демиелинизации. Поскольку при аксональной дегенерации гибнет лишь часть нервных волокон, образующих нерв и при этом проведение импульса по пораженному нерву полностью не прерывается, не смотря на отчетливые клинические признаки патологии, скорость проведения возбуждения не изменяется, но при этом уменьшается амплитуда регистрируемого сигнала. При сегментарной демиелинизации на начальных этапах проводимость по пораженным волокнам не прерывается, но существенно снижается скорость распространения сигнала.
Электоромиографические исследования позволяют оценить выраженность денервации мышечных волокон, развивающейся вследствие гибели нервных волокон, иннервирующих мышцу.
Методами оценки степени тяжести токсических энцефалопатий являются электроэнцефалография (ЭЭГ) и психофизиологические исследования. При исследовании нейропсихологического статуса обычно оценивают уровень интеллекта, речевые способности, внимание, позновательную способность личности, память, координированность движений и т.д. Описан синдром хронической интоксикации органическими растворителями. Он включает: головные боли, частую смену настроения, спутанность сознания, повышенную утомляемость, ухудшение памяти, частое депрессивное состояние, парестезии по ходу периферических нервов. Однако в целом, и эти виды исследования не являются специфичными в диагностике нейротоксических эффектов.
<< Содержание |

 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки