
|
Медико-биологический
информационный портал
|
|
для специалистов |
|
ТОМ 5, СТ. 85 (стр. 248-250) // Июнь 2004
ВЛИЯНИЕ ПЕРФТОРАНА НА ЗАЖИВЛЕНИЯ МЯГКИХ И КОСТНЫХ РАН У КРЫС А.А. Орлов 1, А.С. Григорян 1, И.Г. Мариничева 1, В.П. Ипполитов 1, Н.Б. Кармен 2, Е.И. Маевский 2 1ЦНИИ стоматологии, Москва, 2ИТЭБ РАН, Пущино
Исходы реконструктивных операций в челюстно-лицевой хирургии при пересадке свободных кожных лоскутов в значительной мере определяются состоянием микроциркуляции и кислородного снабжения тканей. В этой связи особый интерес представляет использование перфторана - препарата на основе эмульсии перфторуглеродов, обладающего способностью переносить кислород и углекислый газ (2,3). Учитывая нормализующее воздействие перфторана на микроциркуляцию (1,6), а также возможные антиоксидантные свойства препарата и его коррегирующего влияние на тканевой метаболизм (4,5), мы поставили задачу изучить воздействие аппликаций и внутривенного введения перфторана на динамику заживления стандартных экспериментально воспроизведенных костных ран.
Материал и методы исследования. Крысам самцам линии Wistar массой 250-300 г под калипсоловым наркозом (калипсол вводился внутрибрюшинно, при необходимости поддержания анестезии калипсол вводился внутримышечно; средняя доза калипсола 16,9+1,1 мг/100 г веса) наносили повреждение мягких и костных тканей. Производился разрез кожи и подкожной клетчатки по передней поверхности левого бедра длиной 1,5 см. Тупым путем выделялась бедренная кость в области метафиза. Надкостница рассекалась, края раны разводились острыми крючками. В области метафиза создавалось трепанационное отверстие бором © 2. Костный дефект тампонировался коллагеновой гемостатической губкой Для забора органов и тканей на гистологическое исследование через 1, 3, 5, 10 и 30 суток после оперативного вмешательства животных забивали под калипсоловым наркозом (750 мг/кг) путем остановки дыхания листеноном (200 мг на кг массы животного). Материал, подлежащий исследованию (бедренные кости, мягкие ткани бедра), помещали в 10% формалин и после дегидратации в спиртах заливали в парафин. Серийные срезы окрашивали гематоксилин-эозином и изучали при увеличении 100-200. Наряду с гистологической оценкой проводили полуколичественный анализ выделенных морфологических критериев (более 40) по пятибалльной системе для оценки состояния тканевых структур в области костных дефектов. В таблицах приведены средние значения оценок. В экспериментах использовался перфторан (ОАО НПФ <Пертфоран>, г. Пущино) серии 55101 от 20.09.2001 г. (ВФС 42-2576-99, срок годности до октября 2004 г.), Калипсол - производства Результаты морфологического контроля суммированы в таблицах и рисунках, где представлены сравнительные характеристики признаков воспалительной альтерации (табл. 1 и рис. 1), развития пролиферации и регенерации (табл. 2 и рис. 2) в раневой и прилежащей зоне после повреждении кости и мягких тканей в контроле (стандартное лечение без эмульсии ПФОС) и при внутривенном и местном использовании перфторана. В 1-е сутки после операции во всех 3 группах наблюдений в области метафиза бедренной кости у животных обнаруживался правильной формы полулунный костный дефект с ровным четко очерченным краем, частично лишенным остеоцитов. Обширный дефект костной ткани, был заполнен частью осколками кости, лишенными остеоцитов, частью фибрином, свободнолежащими эритроцитами и обрывками некротизированной ткани. Мягкие ткани у входа в дефект подвергались деструкции. Мышечные волокна некротизировались, образуя бесструктурные оксифильные массы. Крайне выраженным был отек ткани. Кое-где отмечалось выпадение нитей фибрина. Однако лейкоцитарный инфильтрат носил главным образом диффузный характер, на обширной территории полинуклеары в виде цепочек выстраивались вдоль подвергающихся некробиозу и некрозу мышечных волокон. Следует заметить, что уже в 1 сутки лейкоцитарная инфильтрация в обеих группах с перфтораном (внутривенное и местное введение) была довольно умеренной и определенно уступала в интенсивности тому, что наблюдалось в контрольной группе, где плотный гнойный инфильтрат образовывал обширные фокусы, пропитывал мышечную ткань, усиливая процесс ее разрушения. Таблица 1. Оценка степени повреждения тканевых структур в области травмы
* в/т - внутритканевая инфильтрация 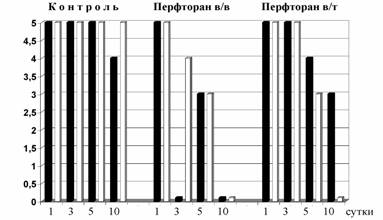 Рис.1. Влияние внутривенного и местного введения перфторана на интенсивность (темные столбцы) и распространенность (светлые столбцы) некротических изменений в ране. Через 3-е суток после операции в области травмы по-прежнему определялся дефект кости с выраженными проявлениями перифокальных эффектов повреждения. На фоне выраженных посттравматических деструктивных изменений в группах, где применяли перфторан (как местно, так и внутривенно) в самих костных дефектах отмечалось образование соединительнотканной формации, на наш взгляд, обладавшей определенными остеогенетическими потенциями. Об этом свидетельствовало появление в ней микроучастков эозинофильного пропитывания межклеточного вещества, как бы намечающего образование остеоида. Кое-где здесь было отмечено формирование нежных бесформенных отложений остеоидного вещества. У прилежащих к этой зоне материнских костных трабекул располагались отдельные гигантские остеокласты. Межтрабекулярные пространства вблизи от дефекта были заполнены рыхлой соединительной тканью, лишенной кроветворных элементов. Основными клеточными эле-ментами здесь были фибробласты с примесями лимфоцитов и макрофагов, а так же единичных сегментоядерных лейкоцитов с эозинофильной цитоплаз-мой. На 5-е сутки эксперимента на периферии мягкотканного регенерата, сформировавшегося в костных дефектах наблюдалось появление обширных зон более плотной и со сниженной клеточностью остеогенной формации, в которой происходила консолидация межклеточной субстанции, появление которой расценивалось как предстадия формирования остеоидного матрикса. Таблица 2. Оценка состояния тканевых структур в области экспериментального воздействия по уровню регенерации (1 - 10 сутки)
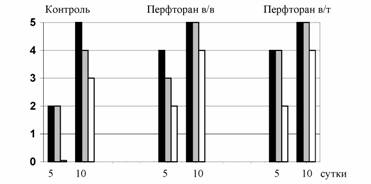 Рис. 2. Сравнение параметров образования костного вещества в контроле и при использовании пертфорана: темная штриховка - в периосте, серая - в эндоосте, без штриховки - созревание новообразованных структур. Само новообразование костных структур в группах с использованием перфторана было наиболее выраженным в периостальной зоне, где наблюдалась интен-сивная пролиферация клеточных элементов надкостницы и формировались напластования нового костного вещества, образованного в центре из нежных остеоидных балок (ближе к входу в костный дефект), а отступя от него - из более мощных фиброзных трабекул и костно-хрящевых структур. На уровне дефекта кости в группах с внутривенным и местным введением перфторана так же отмечалось появление новых костных структур, в частности за пределами дефекта, занятого клеточноволокнистой остеогенной тканью, обнаруживались участки узкопетлистой трабекулярной сеточки из фиброзного костного вещества, разительно отличавшегося от субстанции расположенных по соседству материнских структур более низким уровнем дифференциации. Эндостальный гистогенез таких участков новообразованной костной ткани был не бесспорным, так как они могли происходить и из периостальных элементов, бурно пролиферирующих на этой стадии форми-рования костной мозоли. На 10-е сутки наблюдения интенсивность новообразовательных и протекающих одновременно с ними заместительных процессов достигала в области травмы своего апогея. Определенно, наиболее высокой продуктивная реакция была у периостальных элементов. Пролиферирующие клетки со стороны надкостни-цы, образуя клеточные массивы, продвигались в костный дефект в составе клеточноволокнистой остеогенной ткани, где претерпевали остеобластическую дифференцировку и формировали остеоидные а по их созревании - фиброзные костные трабекулы, образующие узкопетлистую сетку костного регенерата, почти полностью заполнившего к 10 суткам наблюдений дефект кости. В эти сроки в контроле обнаруживались отчетливые морфологические проявления повреждения и реакций на них, такие как микроочаги некроза и воспалительный иногда подостро текущий процесс (в одном из случаев в мягких тканях был обнаружен абсцесс). После внутривенного введения перфторана, в отличие от контроля, наблюдалось почти полное элиминирование некротически измененных тканевых структур и элементов и происходило затухание острых перифокальных воспалительных реакций. На 30-е сутки при сопоставлении гистологических картин с тем, что наблюдалось в контрольной группе, следует от-метить несколько чрезвычайно важных моментов. В контроле отмечались изъеденность костного края и большое число гигантских многоядерных остеокластов в узурах резорбции. Характер соединительной ткани, заполнившей краевые дефекты, позволял квали-фицировать ее как клеточноволокнистую формацию с невыраженными проявлениями остеогенетической дифференцировки ее элементов. Активного отложения нового костного вещества здесь не наблюдалось. После внутривенного введения перфторана, как указывалось, также обнаруживались краевые дефекты кости. Однако их морфологические характеристики были иными. Прежде всего, костный край здесь был преимущественно ровным, без признаков резорбтивного узурирования, и встречались лишь единичные гигантские многоядерные остеокласты. Ткань, заполнявшая краевые дефекты, характеризовалась типичными чертами остеогенной формации, количество клеточных элементов в ней снижалось, межуточное вещество местами оказывалась диффузно пропитанной белковым материалом, намечалось отложение остеоида. Часто на больших участках и даже отстоящих несколько от костного края появлялась оксифильная субстанция остеоида, не оформленная в виде трабекул. В тоже время здесь же рядом или отступя можно было видеть построение типичных остеоидных балок. Воспалительных проявлений в эти сроки наблюдений не отмечалось. В области травмы обнаруживалось, практически, полное восстановление мышечной ткани, лишь местами можно было видеть группы мышечных волокон с явными признаками остаточных дистрофических изменений, в частности, с зернистой либо гомогенизированной саркоплазмой. Вследствие интенсивных продуктивных реакций соединительно-тканные элементы, которые обнаруживались и в более ранние сроки, превращались к этому сроку в мощный пласт фиброзной соединительной ткани, расположенный в области травмы между костью и мышечной тканью. Таким образом, результаты исследования тканевого материала в отдаленные сроки свидетельствуют о том, что использование перфторана способствовало лучшему заживлению костной раны и повреждения мягких тканей. Причем наблюдалось более быстрое прекращение вторичного воспалительного повреждения мягких тканей, прилежащих к кости и ускорение восстановления разрушенных мягкотканных и костных структур. Выводы: Перфторан обладает противовоспалительными свойствами, что проявляется в снижении лейкоцитарной инфильтрации вне зависимости от способа введения перфторана Использование перфторана способствует усилению остеогенеза, обеспечивает уже в ранние сроки более высокий, чем в контроле, уровень дифференцировки фиброзного костного вещества. Внутривенное и местное использование перфторана при лечении костной раны и повреждения мягких тканей способствует лучшему заживлению, за счет уменьшения вторичной деструктивной альтерации и стимуляции восстановления разрушенных мягкотканных и костных структур. Литература. 1. Багненков С.Ф., Стейко Ю.М., Нохрин С.П. Опыт применения перфторана при лечении окклюзирующих заболеваний артерий нижних конечностей в стадии критической ишемии.// Перфторорганические соединения в биологии и медицине. Пущино, 2001, с. 128-129. 2. Иваницкий Г.Р. Биофизические основы создания перфторуглеродных сред и газотранспортных заменителей. //Перфторорганические соединения в биологии и медицине. Пущино, 2001, с. 4-49. 3. Кузнецова И.Н. Биофизические механизмы газотранспортной функции эмульсий перфторуглеродных соединений.// Перфторорганические соединения в биологии и медицине. Пущино, 1999, с. 275-279. 4. Онищенко Н.А., Гульмухамедов Б.А., Расулов М.Ф. и др. Индукция монооксидазной активности печени перфтораном при перитоните.// Физиологически активные вещества на основе перфторуглеродов в военной медицине. СПб, 1997, с. 37-42. 5. Носов А.В., Шилов В.В., Полозова Е.В., Иваницкий Ю.Ю. Модификация перфтораном защитной эффективности сукцината натрия при интоксикации дафний циклофосфаном в условиях гипоксии.//Физиологически активные вещества на основе перфторуглеродов в военной медицине. СПб, 1997, с. 156-161. 6. Усенко Л.В., Гармаш О.С., Забошный С.И. Противоишемичсекая защита почек с использованием перфторана у больных с уросепсисом у больных с послеоперационном периоде.// Перфторорганические соединения в биологии и медицине. Пущино, 2001, с. 120-128. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006
Свидетельство о регистрации сетевого электронного научного издания Медлайн.Ру - N 227 от 20 октября 2008 года.
Выдано ФГУП "Информрегистр" Журнал основан 16 ноября 2000г.
Выдано Министерством РФ по делам печати, телерадиовещания и средств массовых коммуникаций
(c) Перепечатка материалов сайта Medline.Ru возможна только с письменного разрешения редакции
|
|
| Размещение рекламы | |
|
| |

 Articles
Articles
