
|
Медико-биологический
информационный портал
|
|
для специалистов |
|
ТОМ 5, СТ. 80 (стр. 238-239) // Июнь 2004
ИНТЕНСИФИКАЦИЯ БИОСИНТЕЗА БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ БАКТЕРИЯМИ И МИКРОМИЦЕТАМИ ПОД ВЛИЯНИЕМ ПЕРФТОРУГЛЕРОДОВ М.К. Бакулин, Е.В. Пименов, И.В. Дармов, А.С. Кучеренко, Л.В. Бакулина, Н.А. Кривошеина Вятский государственный университет, Киров
Современная биотехнология интенсивно разрабатывает технологии получения биологически активных веществ антибиотиков, ферментов, витаминов, гиббереллинов и других соединений, продуцируемых бактериями и микроскопическими грибами. Большинство используемых для этих целей микроорганизмов обладает интенсивным аэробным метаболизмом и им, также как и всем микроорганизмам с интенсивными процессами обмена, жизненно необходим кислород. Для микромицетов и бактерий, растущих на поверхности плотных питательных сред или в тонких слоях жидкости в присутствии воздуха, кислорода вполне достаточно. Однако в настоящее время уже общепризнанно, что больший выход целевого продукта при меньших затратах обеспечивает глубинное культивирование. В то же время в культуральной среде глубинным культурам микроорганизмов не хватает растворенного кислорода [1]. Для нормального роста аэробных микроорганизмов в глубоких слоях по мере удаления от поверхности требуется аэрация. Большой практический интерес представляло изучение возможности использование для этих целей перфторорганических соединений с газотранспортной функцией [2].
Возможность увеличения продукции микроорганизмами биологически активных веществ была исследована с использованием бактерий и микромицетов продуцентов антибиотиков. В работе использованы два штамма пеницилл продуцентов пенициллина и два штамма стрептомицетов продуцентов рубомицина. Penicillium chrysogenum МВ 21 и МВ 104 - штаммы микромицетов, выделенные из садовой почвы, обладают типичными для пеницилл культурально-морфологическими и тинкториальными видовыми свойствами, энергию получает путем аэробного дыхания. Морфологически представляют кистевидную плесень, конидиеносец со стеригмами имеет вид кисточки, на концах стеригм цепочки конидий. На агаре Чапека колонии до 30 - 34 мм в диаметре, складчатые, бархатистые, край белый, конидиальная зона зеленая, реверзум лимонного цвета. Оптимальная температура роста (28-30)оС. Streptomyces purpurogeniscleroticus ВБМ 158 и ВБМ 81 - штаммы бактерий актиномицетов. Продуценты антибиотика рубомицина, обладают типичными культурально-морфологическими и тинкториальными свойствами, аэробы. Воздушный мицелий развит. Имеются особые воздушные гифы (спорофоры) и мицелий прорастающий в толщу питательной среды. При микроскопии в мазках, окрашенных по Граму, бактериальные клетки имеют вид тонких длинных ветвящихся нитей, окрашенных грамположительно. На плотной питательной среде колонии красновато-малинового цвета. Колонии имеют неровные края шероховатую поверхность с кратерообразным вдавлением в центре. В процессе выращивания на ППС колонии выделяют пигменты, окрашивающие агар соответственно в малиновый цвет в кислой среде и в фиолетовый в щелочной. Оптимальная температура роста (28-30)оС. Для тестирования активности антибиотиков использовали культуры штаммов бактерий. Escherichia coli M 17 - штамм кишечной палочки получен из медицинского сертифицированного препарата <Колибактерин>, предназначенного для лечения желудочно-кишечных расстройств у людей. При микроскопии агаровой культуры данного штамма отмечаются прямые одиночные и парные грамотрицательные палочки. Факультативный анаэроб, оптимум роста отмечается при температуре 35-37oC, хорошо размножается при комнатной температуре на обычных средах. На мясо-пептонном агаре отдельные клоны развиваются в виде слабовыпуклых полупрозрачных сероватых колоний, в бульоне вызывает диффузное помутнение с образованием осадка. Bacillus subtilis 91 - сенная палочка. При микроскопии отмечаются грамположительные, крупные (3-8*1-1,5мкм) палочки с закругленными концами; расположены одиночно, парами или цепочками. Аэроб или факультативный анаэроб. Разжижает желатину, гидролизует крахмал, казеин, ферментирует глюкозу и мальтозу. Хорошо размножается на простых питательных средах. На поверхности агара через сутки клоны образуют шероховатые колонии с неровными краями. Рост в бульоне характеризуется появлением белых хлопьев, оседающих на дно пробирки. Staphylococcus aureus 208 - золотистый стафилококк. Штамм выделен с поверхности слизистых покровов ротовой полости человека, высокочувствителен к пенициллинам и цефалоспоринам. При микроскопии отмечаются одиночные, парные или в виде виноградных гроздей грамположительные кокки. Температурный оптимум роста 30-37оС, штамм устойчив к повышенному содержанию (5 - 10%) NaCl. На плотной среде через 18-24 ч культивирования в аэробных условиях бактерии формируют мутные круглые колонии кремового или желтого цвета. Pseudomonas putida ВУ38 - культура выделена из почвы ризосферы зерновых растений и может использоваться в качестве экзосимбионта для улучшения роста культурных растений. При микроскопии отмечаются грамотрицательные палочки размером 1,5-3,0*0,5-0,8 мкм. Культивируется на обычных питательных средах. Облигатный аэроб. Для выращивания бактерий и микромицетов использовали мясо-пептонный бульон (МПБ) и мясо-пептонный агар (МПА) и стандартные среды: агар Чапека, среду Чапека-Докса, приготовленные по рекомендованным прописям и технологии [3]. Для выращивания стрептомицетов использовали жидкую питательную среду с соевой мукой, содержащую крахмал - 3,0%; соевую муку - 3,0%; (NH4)2С4Н4О6 - 0,5%; (NH4)2SO4 - 0,4%; CaCO3 - 0,8%; K2HPO4 - 0,01%; глюкозы - 1,5% (вводится в стерильную питательную среду); воды водопроводной до 100%. Практический интерес представляли результаты экспериментов по оценке влияния внесения перфтордекалина в среду культивирования на продукцию антибиотика рубомицина S. purpurogeniscleroticus при росте на среде на основе соевой муки. Засев колб проводился стандартизованными культурами, выращенных на среде, на основе соевой муки, до конечного содержания в среде 50 мг% биомассы Streptomyces purpurogeniscleroticus. Выращивание в колбах проводится при температуре (27:29)оС на шуттеле со скоростью вращения 250 об/мин. Через каждые 48 часов культивирования отбирались пробы по 5 см3, в которой оценивается чистота культуры и её морфологическая типичность путём микроскопии мазков, окрашенных по Граму, и проводился гидролиз культур с последующим определением содержания рубомицина методом газо-жидкостной хроматографии и по подавляющей активности в отношении культур Staphylococcus aureus 208, Escherichia coli M17, Pseudomonas putida ВУ38 в сравнении с стандартным раствором рубомицина. Гидролиз нативных культур Streptomyces purpurogeniscleroticus ВБМ 158 и ВБМ 81 проводили следующим методом. После отбора пробы культуральной среды в нее вводится 10% раствор трилона Б в количестве 0,05% по сухому весу и выдерживается в течение 30 минут. После этого рН культуральной жидкости доводится до 3,0+0,2 введением раствора щавелевой кислоты. Затем культуральная жидкость нагревается до температуры (87:89)oC, выдерживается при данной температуре 45 минут и максимально быстро охлаждается до температуры (4:10)oC. На следующем этапе, с целью высаливания белка, в пробу вводится NaCl в количестве 5 мг/мл и рН культуральной жидкости доводится 10% раствором гидроокиси натрия до 5,5. После проведения гидролиза культур оценивали содержание рубомицина в гидролизате методом газо-жидкостной хроматографии и методом диффузии в агар с помощью дисков по подавляющей активности в отношении культур бактерий в сравнении с стандартным раствором рубомицина (табл. 1). Таблица 1. Влияние перфтордекалина на продукцию рубомицина при росте Streptomyces purpurogeniscleroticus на среде с соевой мукой
Примечание. В настоящей таблице и последующих таблицах приведены средние арифметические данные по четырем-шести определениям. Отклонение единичного определения от средней арифметической во всех случаях не превышало 15%. 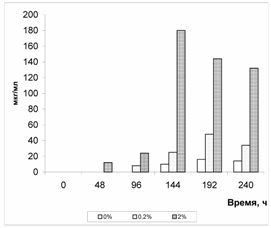 Рис.1. Влияние перфтордекалина на содержание рубомицина в среде культивирования актиномицетов Streptomyces purpurogeniscleroticus ВБМ 81 Для тестирования биологической (микробоцидной) активности жидких культур была разработана методика, которая основана на принципе использования диффузии активного вещества, угнетающего рост чувствительных к нему микроорганизмов, из создаваемого депо в агар. Определение проводили сравнительным методом по подавляющей активности на МПА в отношении культур Staphylococcus aureus 208, Bacillus subtilis 3, Escherichia coli M17, Pseudomonas putida ВУ38 в сравнении со стандартным раствором рубомицина. Принцип метода заключается в том, что на поверхность плотной питательной среды в чашках Петри, засеянной испытуемыми культурами тест-микроорганизмов, по периметру размещают бумажные диски и наносят на них заданный объем соответствующих разведений антибиотических субстанций, после чего чашки инкубируют в термостате при температуре 28oC. Антибиотическая субстанция диффундирует из диска в агар и при этом ингибирует рост чувствительных к нему бактерий. Наличие зоны задержки роста микроорганизмов вокруг дисков свидетельствует о чувствительности микроба к данной концентрации антибиотика в среде, а размеры зоны ингибирования зависят от его концентрации, активности и чувствительности тест-микроорганизма. В каждую чашку Петри помещали 4 - 6 дисков. Диски размещали на равном расстоянии один от другого и на расстоянии 1,5 - 2 см от края чашки, а для тесного контакта со средой плотно прижимали к поверхности пинцетом, следя за тем, чтобы не были положены два сцепленных между собой диска. На диски микропипеткой наносили по 20 мкл исследуемых культуральных жидкостей и их последовательных разведений. Затем закрытые чашки Петри помещали на 24 часа в термостат при 28oC, после чего проводили определение диаметров зон задержки роста вокруг дисков. Отмечали наличие выраженных зон задержки роста, которые хорошо выделяются на полупрозрачной агаровой среде в проходящем свете. Результаты оценки содержания рубомицина в гидролизатах проб культуральной среды при глубинном выращивании культур актиномицетов S. purpurogeniscleroticus, мкг/см-3, взятых через каждые 48 часов роста свидетельствовали, что максимальное накопление антибиотика в культуре происходило на восьмые сутки культивирования. Внесение в среду перфтордекалина существенно сказывалось на ускорении процесса накопления и увеличение содержания антибиотика в среде. Так максимум концентрации рубомицина в среде при культивировании с 2% перфтордекалина достигали через шесть суток, в контроле только через восемь. При этом концентрация антибиотика в первом случае через двое суток роста была такой же, как в контроле на достигнутом максимуме через восемь суток, а через шесть суток в 10-11 раз выше, чем достигаемый максимум рубомицина в среде без перфтордекалина. Аналогичные результаты были получены при изучении влияния перфторана и перфтордекалина на продукцию микромицетом Penicillium chrysogenum пенициллина на среде Чапека - Докса (табл.2 и 3). Таблица 2. Влияние перфторана на продукцию пенициллина при росте Penicillium chrysogenum на среде Чапека - Докса
Таблица 3. Влияние перфтордекалина на продукцию пенициллина при росте Penicillium chrysogenum на среде Чапека - Докса
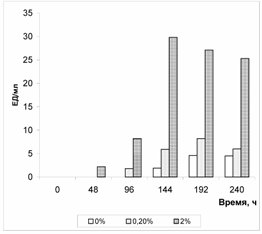 Рис.2. Содержание пенициллина в среде культивирования Penicillium chrysogenum при росте в среде Чапека - Докса с добавлением перфтордекалина Оценка содержания пенициллина в культуральной среде проводилась в сравнении со стандартным раствором антибиотика, аналогично тому, как это было сделано при изучении продукции рубомицина. Изменение содержания пенициллина в культуральной среде с добавлением перфторана и перфтордекалина при росте микромицета Penicillium chrysogenum представлены в табл. 2 и 3. Результаты исследований, представленные в табл. 2 и 3 свидетельствуют о перспективности использования ПФОС с газотранспортной функцией для стимуляции процесса образования антибиотиков при глубинном культивировании продуцентов пенициллина Penicillium chrysogenum МВ 104 и МВ 21. Так через 6 суток культивирования Penicillium chrysogenum МВ 104 (пик концентраций антибиотика в культуральных средах с перфтораном и перфтордекалином) концентрация пенициллина в исследуемых культуральных средах с ПФОС в 5,8 и в 6,5 раз, соответственно, превышала концентрацию его в контрольной среде, не содержащей перфторуглеродов. Более того, эксперименты показали, что с помощью ПФОС можно получить продукцию антибиотика на среде Чапека-Докса у культур штаммов, которые при использовании обычной технологии не продуцировали выявляемых концентраций антибиотика (Penicillium chrysogenum МВ 21, табл.3). Полученные результаты свидетельствуют о несомненной целесообразности дальнейших исследований по использованию ПФОС для получения разнообразных биологически активных веществ, продуцируемых микроорганизмами [4-6]. Литература 1. Промышленная микробиология / Под ред. Н. С. Егорова. - М.: Высшая школа, 1989. - 688 с. 2. Иваницкий Г. Р. Биофизические основы создания перфторуглеродных сред и газотранспортных кровезаменителей (обзор) //Сборник научных трудов НПФ <Перфторан>: Перфторорганические соединения в биологии и медицине. - Пущино: ПНЦ РАН, 2001. Вып. XI. - С. 4-48. 3. Лабинская А. С. Микробиология с техникой микробиологических исследований. - М.: Медицина, 1978. - 392 с. 4. Бакулин М. К., Кривошеина Н. А., Кучеренко А. С. и др. Разработка машиночитаемой базы данных активности перфторуглеродов в отношении микроорганизмов//Сборник материалов Всероссийской науч.-техн. конф. <Наука-производство-технологии-экология>, Киров, ЦДООШШ, 2003, Т.©3. - С. 86-87. 5. Бакулин М. К., Кучеренко А. С., Золотарев А. Г., Кривошеина Н. А. Нужна ли <голубая кровь микроорганизмам>?// МВФ. Медицина. Фармация, 2003, © 2. - С. 7-11. Бакулин М. К., Кучеренко А. С., Кривошеина Н. А. и др. Влияние перфторана и перфтордекалина в питательных средах на биосинтез у микромицетов//Сборник материалов Всероссийской науч.-техн. конф. <Наука-производство-технологии-экология>, Киров, ЦДООШШ, 2003, Т.©3. - С. 88-89. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006
Свидетельство о регистрации сетевого электронного научного издания Медлайн.Ру - N 227 от 20 октября 2008 года.
Выдано ФГУП "Информрегистр" Журнал основан 16 ноября 2000г.
Выдано Министерством РФ по делам печати, телерадиовещания и средств массовых коммуникаций
(c) Перепечатка материалов сайта Medline.Ru возможна только с письменного разрешения редакции
|
|
| Размещение рекламы | |
|
| |

 Articles
Articles
