
|
Медико-биологический
информационный портал
|
|
для специалистов |
|
ТОМ 5, СТ. 90 (стр. 256-257)
ТОКСИКОКИНЕТИЧЕСКИЕ ОСОБЕННОСТИ ИНТОКСИКАЦИИ НОРБОРНАНОМ У КРЫС В.Д. Гладких*, В.Б. Назаров*, А.И. Головко**, М.Б. Иванов**, С.П. Сидоров**, Ю.В. Шилов** * Военный университет радиационной, химической и биологической защиты, г. Москва ** Военно-медицинская академия им. С.М. Кирова, г. Санкт-Петербург
РЕЗЮМЕ
На основе анализа экспериментальных данных показано, что проявления токсического процесса при интоксикации обратимыми и необратимыми ингибиторами хлор-ионных каналов ГАМК-рецепторов принципиально однотипны. Различия, в быстродействии, обусловлены скорее токсикодинамическими, а не токсикокинетическими процессами, протекающими в организме грызунов. Не исключается вероятность общности процессов биотрансформации посредством монооксигеназной системы, в силу их высокой гидрофобности. Ключевые слова: норборнан, токсикокинетика, токсикодинамика, хлор-ионофор, ГАМК-рецептор, судороги. ВВЕДЕНИЕ Согласно современным представлениям судорожная активность соединений "клеточной структуры" обусловлена нарушением ГАМК - зависимой хлор ионной проводимости нейрональных мембран. Соединения данного класса: пикротоксин, дисульфотетраазаадамантан (ДСТА), t-бутилбициклофосфат (t-БЦФ), t-бутилбициклоортобензоат (t-БЦОБ) - обратимо; пара - и мета - изоцианатные аналоги t-БЦОБ, норборнан - необратимо блокируют хлорионофор ГАМКА - рецепторно-канального комплекса (РКК) [2, 9]. Имеющиеся экспериментальные данные по оценке характера проявлений токсического процесса при отравлении антагонистами хлор-ионных каналов (ХИК) ГАМКА-рецепторов свидетельствуют о принципиальном сходстве течения интоксикации необратимыми и обратимыми блокаторами ХИК. У животных отравленных эквитоксичными дозами ДСТА и норборнана наблюдаются однотипные симптомы интоксикации. При этом, для обратимых блокаторов ХИК характерно стремительное развитие интоксикации, а проявления токсического действия норборнана характеризуются наличием скрытого периода в развитии симптомов интоксикации и отсроченной гибелью животных [2, 6, 8, 10]. Таким образом, различия в характере быстродействия, оцениваемые по времени возникновения судорог ("tсуд") и времени гибели ("tгиб"), являются отличительным признаком проявления интоксикации обратимыми и необратимыми блокаторами ХИК на уровне летальных доз. В то же время соотношение величин "tгиб" к "tсуд", характеризующее напряжённость адаптивно-компенсаторных реакций при отравлении эквитоксичными дозами "клеточных конвульсантов", приблизительно равно, как в случае обратимых, так и необратимых блокаторов ХИК. Различия в характере быстродействия обратимых и необратимых блокаторов хлор-ионофора сохраняются в широком диапазоне вводимых доз: от 1 до 10 ЛД50. Анализ выявленных зависимостей быстродействия от дозы позволяет полагать, что срыв адаптивно-компенсаторных реакций при увеличении интенсивности воздействия наступает быстрее в случае необратимых блокаторов ХИК, чем в случае обратимых. Как уже отмечалось, обратимые (по сравнению с необратимыми) блокаторы ХИК, характеризуются определёнными особенностями проявления токсического действия. В какой мере эти различия обусловлены особенностями токсико-кинетических, в какой, - спецификой токсико-динамических процессов? Универсальными параметрами для описания токсикокинетики и токсикодинамики физиологически активных веществ (ФАВ) являются коэффициенты их распределения в различных водно-органических системах (logP). При изучении физико-химической природы физиологической активности конвульсантов "клеточной структуры" широко используются различные методы математического моделирования зависимости "структура - активность". В полученных корреляционных уравнениях обращают на себя внимание большие величины коэффициентов при членах, учитывающих гидрофобные свойства молекул. Анализ различных моделей (применительно к различным структурным типам "клеточных конвульсантов") свидетельствует о том, что биодоступность этих соединений определяется их гидрофобными, а взаимодействие с биомишенями - гидрофобными и стерическими характеристиками заместителей в различных положениях базовых циклических структур [5]. Целью нашего исследования явилось сравнительное исследование особенностей распределения в тканях обратимых и необратимых блокаторов ГАМК-зависимых ХИК в зависимости от их гидрофильности на примере ДСТА и норборнана, характеризующихся одинаковым уровнем токсичности. МАТЕРИАЛЫ И МЕТОДЫ Количественное определение концентрации веществ в растворах выполняли на газожидкостном хроматографе (GC HP5890 & FID фирмы Hewlett Packard. США) с пламенно-ионизационным детектором, путем разделения анализируемой пробы в капиллярной колонке детектирования с последующей регистрацией сигналов детектора в цифровой форме на ЭВМ. Определение концентрации норборнана и ДСТА в биопробах (кровь, печень, мозг) производили при различных путях введения крысам исследуемых веществ в дозах 2-6 ЛД50. Пробы биотканей готовили по стандартным методикам. Экстрагирование веществ из плазмы проводили при помощи хлористого метилена, из мозга и печени - ацетонитрилом. Количественное определение исследуемых веществ осуществляли по площади пика, с учётом результатов предварительной калибровки хроматографа и построенного градуировочного графика зависимости величины сигнала атомно-эмиссионного детектора по углероду. Диапазон определяемых концентраций ФАВ составлял от 10-6 до 1 мг/мл. Предел допускаемых значений погрешности результатов измерения, выполняемых по данной методике, не превышал + 10% при доверительной вероятности не менее 0,95. Допускаемые расхождения между двумя параллельными определениями составляли 7%. В дальнейшем, полученные количественные характеристики содержания норборнана и ДСТА в различных средах, с помощью формулы log P = log(Coct-CH2O)/CH2O, где Coct - концентрация вещества в насыщенном растворе октанола; CH2O - концентрация вещества в воде, трансформировали в параметры гидрофобности. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ Установлено, что токсико-кинетические кривые распределения ДСТА и норборнана при введении их в эквитоксичных дозах носят принципиально однотипный характер. Токсико-кинетические кривые распределения норборнана (рис.1), приведённые в качестве примера, отражают фазность развития интоксикации. В пробах плазмы крови исследуемое вещество обнаруживается на 3 минуте с достижением максимальной концентрации к 5 минуте. В дальнейшем наблюдается снижение (к 10 мин) и повторный рост концентрации к 25 минуте. Снижение концентрации вещества в крови совпадает по времени с развитием судорожной реакции, повторное увеличение - приходится на период постконвульсивной депрессии. Тенденция полимодального характера изменения концентрации норборнана во времени, отражающая фазный характер течения интоксикации, наблюдается и при исследовании вещества в пробах печени и мозга. В тканях печени максимумы концентрации вещества приходятся, так же, как и в крови, на латентные периоды, в тканях мозга - на периоды судорожной активности. Можно полагать, что фазность изменения концентрации норборнана в крови, в определённой степени, обусловлена первоначальными процессами его активной и пассивной фиксации с дальнейшей десорбцией из депо в плазму крови. 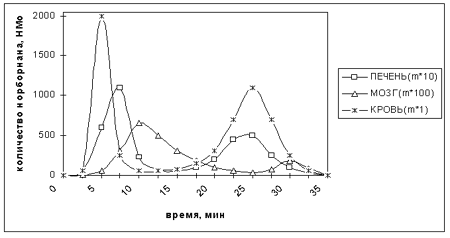
Рис.1. Токсико-кинетические кривые распределения при введении 4 ЛД50 норборнана. В случае ДСТА прослеживается аналогичный характер изменения концентрации вещества в крови, отражающий динамику развития интоксикации, однако полимодальность токсикокинетических кривых распределения выражена в меньшей степени. Расчёт и экспериментальная проверка соотнесения интегрированного количества исследуемых соединений в тест - тканях к общей массе вещества (при внутримышечном введении 2-4 ЛД50) показали, что в кровь поступает не более 19% от введенной дозы норборнана и 26% ДСТА. Эти различия можно объяснить более высокой гидрофобностью норборнана по сравнению с ДСТА (log P соответственно равны: 2,41 и 2,09), а, следовательно, и более выраженной способностью к депонированию на биополимерах и в липидофильных депо. Вид аппликации не оказывает существенного влияния на уровень токсичности конвульсантов "клеточной структуры". Применительно к норборнану, величины ЛД50 (внутривенно, внутримышечно, внутрибрюшинно и перорально) в опытах на крысах составляют соответственно 0,093; 0,135; 0,141 и 0,250 мг/кг. На рисунках 2 - 6 представлены соответственно выборочные хроматограммы и токсико-кинетические кривые распределения норборнана в крови при данных видах аппликации, свидетельствующие, что вид аппликации не оказывает выраженного влияния и на характер резорбции, распределения и элиминации. 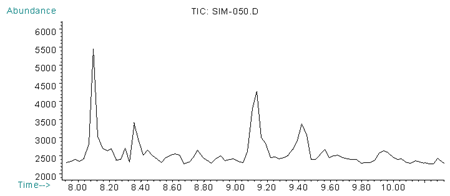
Рис. 2. Хроматограмма по характеристичным ионам (m/z=109, 111, 181) норборнана при внутривенном введении 2,5 ЛД50 (через 30 мин) 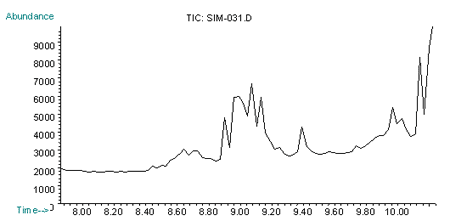
Рис. 3. Хроматограмма по характеристичным ионам (m/z=109, 111, 181) норборнана при внутримышечном введении 2 ЛД50 (через 60 мин) 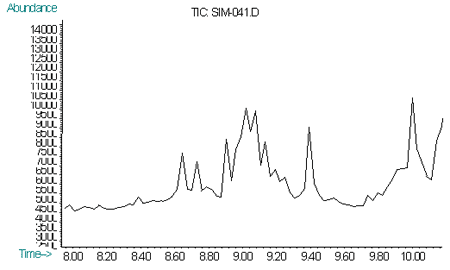
Рис. 4. Хроматограмма по характеристичным ионам (m/z=109, 111, 181) норборнана при пероральном введении 2 ЛД50 (60 мин) 
Рис. 5. Хроматограмма по характеристичным ионам (m/z=109, 111, 181) норборнана при внутрибрюшинном введении 2 ЛД50 (через 60 мин) 
Рис.6. Токсикокинетические кривые распределения норборнана при различных видах аппликации (в относительных единицах) При внутривенном введении, распределившись внутри кровяного русла, норборнан на ~ 95% связывается с липопротеинами и белками плазмы крови (Vr = 95,3 %). Характерно, что его структурные аналоги (дильдрин и линдан) также обладают выраженной способностью фиксироваться на липопротеидах и альбуминах плазмы: Vr соответственно равны 99% и 98% [4]. Пики максимальной концентрации вещества в крови при пероральном, внутрибрюшинном и внутримышечном введении норборнана фиксируются соответственно к 20-ой, 30-ой и 45-ой минутам, соответственно. При различных видах парентерального введения, равно как и при энтеральном, норборнан, помимо связывания с белками, депонируется в липидных тканях. Об этом косвенно можно судить на основании рассчитанных токсикокинетических параметров: площади под кривой (ППК), констант скоростей процессов всасывания (Кinv) и элиминации (Кel), времени полуэлиминации (Т1/2) равных соответственно: 0,4 мкг/час мл; 0,04 час-1; 7,2 час-1; 0,1час (при пероральном введении); 0,9 мкг/час мл; 0,45 час-1; 3,8 час-1; 0,2 час при внутрибрюшинном введении); 0,2 мкг/час мл 0,96 час-1; 2,3 час-1; 0,3 час (при внутримышечном введении). Выраженность к депонированию, в зависимости от рассмотренных видов аппликации, располагается в следующей последовательности внутримышечно (внутрибрюшинно) > перорально. При внутрибрюшинном введении отмечаются более высокие скорости всасывания и более низкие скорости элиминации, чем при пероральном введении (Кinv внутрибрюшинно > Кinv перорально, Kel внутрибрюшинно < Kel перорально). Это создает условия для более длительного нахождения токсиканта в крови (Т? при парентеральном введении превышают таковые показатели по сравнению с пероральным). При пероральном введении процессы очищения крови от норборнана превалируют над процессами инвазии: ППК; Т?; Kel при пероральном и внутривенном введении сопоставимы между собой. Максимальная биодоступность обеспечивается за счет равномерного поступления вещества в область биомишени, что формирует условия для сравнительно быстрого (как при внутривенном, так и при пероральном введении) достижения высоких концентраций вещества в области биомишени и формирования очага патологически усиленного возбуждения, склонного к генерализации. При внутримышечном и внутрибрюшинном введении за счёт выраженного депонирования вещества формируется, по-видимому, торпидный очаг патологически усиленного возбуждения, что и определяет различия в динамике развития интоксикации, связанные с видом аппликации. Выраженная способность конвульсантов "клеточной структуры" к депонированию в липидофильных депо и фиксации на биополимерах согласуется с результатами ингибиторного анализа. Так предварительное (за 6-24 часа) введение аспирина и салициловой кислоты, снижающих сорбционную ёмкость сывороточного альбумина и угнетающих его синтез, приводит к повышению токсичности норборнана и пикротоксина [2]. Результаты совместного действия норборнана и триортокрезилфосфата (ТОКФ), препятствующего образованию комплексов "альбумин - норборнан", свидетельствуют о том, что степень усиления токсичности норборнана зависит от вида аппликации: при внутривенном, внутримышечном и внутрибрюшинном введении усиление токсичности норборнана (под влиянием предварительного за 2 часа введения ТОКФ) составляет соответственно 1,6; 1,4; 1,2 раза, что согласуется с рассмотренными токсикокинетическими особенностями влияния вида аппликации на характер распределения. При совместном действии норборнана, ТОКФ и перфтордекалина (ПФД) - гидрофобного вещества, способного конкурентно взаимодействовать с ксенобиотиками за участки связывания биополимеров, а также индуцировать процессы МОГС, токсичность норборнана возрастает в зависимости от времени введения синергиста. Одновременное введение ТОКФ и ПФД (за 2 часа до введения норборнана) приводит к повышению токсичности норборнана в 2,2 раза; при введении норборнана и ТОКФ на фоне максимального индуцирования оксидаз смешанных функций (ОСФ) посредством ПФД (на 3-и сутки после введения ПФД) токсичность норборнана возрастает всего лишь в 1,6 раза. Это обусловлено, по-видимому, особенностями динамики изменения уровня плазменных белков под влиянием ПФД и метаболизмом ТОКФ на фоне индукции МОГС [1]. Сравнение токсичности блокаторов ГАМК-зависимых ХИК при пероральном и внутримышечном введении позволяет косвенно судить о возможном вовлечении МОГС в процессы их биотрансформации. По-видимому, процессы биотрансформации норборнана связаны, прежде всего, с реакциями микросомального окисления. Это мнение основано, в частности, на результатах оценки совместного действия норборнана с индукторами индуцибельных и конститутивных форм ОСФ (перфтордекалином), обратимым и необратимым ингибитором цитохрома Р-450 (ц-Р-450)(соответственно диметилдитиокарбаматом и нитрозодиметил амином). Выявленный двухфазный характер изменения токсичности норборнана (при модуляции системы МОГС посредством ПФД) позволяет полагать, что норборнан индуцирует процессы МОГС. Первая фаза действия (1-7-е сутки) характеризуется увеличением токсичности конвульсанта в ~1,5 раза; вторая фаза (2-3 неделя) - снижением токсичности в ~1,5 раза. Активация МОГС, инициируемая норборнаном, сопровождается усилением процессов свободнорадикального окисления и перекисного окисления липидов, приводящих к повышению токсичности конвульсанта в течение первой недели. Снижение токсичности норборнана (под влиянием ПФД) отмечается только со второй недели. Характерно, что структурные аналоги норборнана - полихлорированные циклодиены и альдрин также индуцируют повышение активности ц-Р-450 и претерпевают биотрансформацию посредством процессов микросомального окисления [3]. Анализируя литературные и свои собственные экспериментальных данные можно констатировать повышение устойчивости организма млекопитающих к токсическому действию пикротоксина, трет-бутил-БЦФ-ата, ДСТА и норборнана за счёт индукции ОСФ посредством фенобарбитала, бензонала, ПФД [2]. О вовлечении МОГС в биотрансформацию норборнана косвенно свидетельствуют и результаты ингибиторного анализа (токсичность норборнана в опытах на мышах возрастает на фоне предварительного введения необратимого ингибитора ц - Р-450 (нитрозодиметил амина) в 1,4 раза). L.J. Lawrens, J.E. Casida. (1984) на основании результатов совместного действия ингибитора цитохром-Р-450 (пиперонил-бутоксида) и гептохлорборнана-В (токсичность которого в опытах на мышах повышалась в 8 раз) полагали, что соединения "клеточной структуры" вовлекаются в процессы микросомального окисления [7]. Отмечено повышение токсичности норборнана под влиянием пиперонил-бутоксида (ПБО), однако, анализ факторов влияющих на степень синергизма (влияние интервала времени между ведением ПБО и норборнана на степень синергизма; влияние величины вводимой дозы ПБО на выраженность синергизма) свидетельствует, что усиление токсичности норборнана при совместном действии с ПБО, помимо токсико-кинетических, обусловлен токсико-динамическими эффектами, за счёт сенсибилизации хлор-ионных каналов ГАМК-рецепторно-канального комплекса [1]. На основании рассмотренных выше данных о совместном действии норборнана и ФАВ, влияющих на его токсикокинетику, можно предполагать вовлечение в процессы его биотрансформации системы микросомального окисления, модулирование токсикокинетических процессов за счёт изменения сорбционной ёмкости крови под влиянием более гидрофобных соединений о чем свидетельствует повышение токсичности норборнана на фоне индукции МОГС с двухфазным изменением уровня его токсичности. D.S. Milbrath, M.Eto, J.E.Casida (1978), исследуя особенности метаболизма БЦФ-атов, (с учётом природы алкильных заместителей в четвёртом положении бициклической структуры), на основании идентифицированных продуктов распада показали, что биотрансформация этих соединений в организме крыс связана со ступенчатым раскрытием бицикла и последующим окислением метильных групп. По их мнению, различия в токсичности 4- метил-БЦФ-ата (ЛД50, б.мыши = 30 мг/кг) и 4-трет-бутил-БЦФ-ата (ЛД50, б.мыши = 0,036 мг/кг) не могут быть объяснены различиями их метаболизма и особенностями распределения. БЦФ-аты, независимо от природы заместителей в четвёртом положении бицикла, концентрируются преимущественно в мозжечке и подкорковых областях мозга. Устойчивые высокотоксичные метаболиты образуются и в процессе биотрансформации альдрина и гептохлора; реакции эпоксидирования протекают с участием системы микросомального окисления [3]. Образование в процессе биотрасформации более токсичных метаболитов, активация процессов перекисного окисления липидов, вследствие индукции МОГС, приводит к быстрому истощению гомеостатических механизмов детоксикации, повреждению мембран и осложнению течения отравления за счет неспецифических патогенетических механизмов. Тенденция к более выраженной устойчивости самок при интоксикации норборнаном по сравнению с самцами в определенной мере может являться следствием половых особенностей течения токсического стресса (инициируемого избытком стероидных гормонов) в условиях отравления конвульсантами "клеточной структуры"; и более быстрым течением биотрасформации с образованием токсичных метаболитов у самцов. В заключение краткого рассмотрения некоторых вопросов токсикокинетики конвульсантов "клеточной структуры" следует подчеркнуть нерешённость многих проблем, связанных с характером их метаболизма, распределения и выведения их организма. Однако, по нашему мнению, несмотря на определённые токсико-кинетические различия, вытекающие из их структурных особенностей, принципиального влияния на характер проявления токсического действия блокаторов ГАМК - зависмых хлор-ионых каналов они не оказывают. ЛИТЕРАТУРА 1. Гладких В.Д., Колосова Н.А., Лошадкин Н.А. Эффекты совместного действия "бициклогептана" с другими физиологически активными веществами / Токсикол. вестник. -1995. -©6. -С. 12-16. 2. Головко А.И., Головко С.И., Зефиров С.И., Софронов Г.А. Токсикология ГАМК-литиков. -СПб. : Нива, 1996. -144с. 3. Денис В. Парк Биохимия чужеродных соединений 1973. 4. Куценко С.А. Основы гоксикологии: Научно-методическое издание / С.А. Куценко. - СПб: ООО "издательство Фолиант", 2004. - 720 с. 5. Мартынов И.В., Фетисов В.И., Соколов В.Б. Бициклические ортоэфиры кислот фосфора. Итоги науки и техники ВИНИТИ. Сер. Органической химии 1989. 6. Abdul-Ghani A. Changes in ?-aminobutyric acid during different stages of picrotoxin-induced seizure, and the effect of pretreatment with ?-acetylenic GABA and рhenobarbital//J.Biosci.-1989.-Vol.14, © 1.-P.63-67. 7. Lawrence L.J., Casida J.E. Interactions of lindane, toxaphene and cyclodienes with brain-specific t-butylbicyclophosphorothionate receptor//Life Sci.-1984.-Vol.35, © 2.-P.171-178. 8. Manev H., Pericic D., Anic-Stojiljkovic S. Sex differences in the sensitivity of CBA mice to convulsions induced by GABA antagonists are age-dependent//Psychopharmacology.-1987.-Vol.91, © 2.-P.226-229. 9. Moody E.J., Lewin A.H., de Costa B.R. et al. Site-specific acylation of GABA-gated Cl - uptake//Eur.J.Pharmacol.-1991.-Vol.206, © 2.-P.113-118. 10. Rump S. Effects of organophosphates on bioelectrical activity of the brain//Pol. J. Pharmacol. and Pharm.-1990.-Vol.42, © 6.-P.563-572. |
||||||||||
 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006
Свидетельство о регистрации сетевого электронного научного издания Медлайн.Ру - N 227 от 20 октября 2008 года.
Выдано ФГУП "Информрегистр" Журнал основан 16 ноября 2000г.
Выдано Министерством РФ по делам печати, телерадиовещания и средств массовых коммуникаций
(c) Перепечатка материалов сайта Medline.Ru возможна только с письменного разрешения редакции
|
|
| Размещение рекламы | |
|
| |

 Articles
Articles
