|
Медико-биологический
информационный портал
|
|
для специалистов |
|
ТОМ 4, СТ. 79 (стр. 125-127) // Март, 2003 г.
ВОЗРАСТНАЯ ЗАВИСИМОСТЬ ЧАСТОТЫ СТАБИЛЬНЫХ ХРОМОСОМНЫХ АБЕРРАЦИЙ, ОПРЕДЕЛЯЕМЫХ МЕТОДОМ FISH, В ЛИМФОЦИТАХ ЗДОРОВЫХ ДОНОРОВ И ЛИЦ, ПОДВЕРГШИХСЯ НЕКОНТРОЛИРУЕМОМУ ОБЛУЧЕНИЮ В МАЛЫХ ДОЗАХ "Успехи геронтологии", 1999г., выпуск 3 И.Е.Воробцова, Н.М.Тимофеева, А.Н.Богомазова, А.В.Семёнов Центральный научно-исследовательский рентгено-радиологический институт Минздрава РФ, Санкт-Петербург
Исследовали возрастную зависимость частоты стабильных хромосомных аберраций в
культивируемых лимфоцитах здоровых доноров (32
человека), а также лиц, переживших неконтролируемое облучение
в низких дозах (45 человек).
Для визуализации хромосомных обменов использовали метод флуоресцентной in situ гибридизации метафазных лимфоцитов с ДНК-зондами специфичными к 1, 4 и 12 хромосомам. Обнаружено 15-20 кратное увеличение частоты транслокаций у доноров контрольной группы в возрастном интервале от 3 до 70 лет. Частота нестабильных хромосомных обменов (дицентрики и кольца) увеличивается с возрастом значительно медленнее. Возрастная зависимость обоих типов обменов удовлетворительно описывается квадратичной моделью, что свидетельствует о возрастном ухудшении процессов репарации ДНК. Уровень транслокаций у лиц экспонированной группы выше, чем у контрольных доноров того же возраста. Полученные данные доказывают, что стабильные хромосомные аберрации накапливаются с возрастом и сохраняются в течение долгого времени после облучения. Обсуждается возможность использования хромосомных аберраций в качестве маркеров опухоли при расчетах канцерогенного риска.
Старение можно определить как увеличивающуюся с возрастом вероятность возникновения дегенеративных болезней (рак, аутоиммунные заболевания, сердечно-сосудистая патология и т.д.) и смерти. Скорость процесса обусловлена как индивидуальной генетической программой, так и факторами окружающей среды, действующими в течение жизни на организм. Много работ было посвящено изучению зависимых от возраста биологических параметров и поиску тех, которые играют ключевую роль в старении и, соответственно, сформулировано много гипотез (2, 10, 16). Гипотеза, рассматривающая в качестве причины старения спонтанные мутации в соматических клетках, концептуально представляется наиболее логичной. Действительно, ДНК определяет все основные клеточные функции, она чувствительна к действию различных физических и химических факторов, ее изменения передаются дочерним клеткам. Кроме того, эта гипотеза подтверждается рядом клинических и экспериментальных фактов. Во первых - у человека существуют наследственные синдромы преждевременного старения, обусловленные различными дефектами репарации ДНК (11). Во вторых - ионизирующие излучения, а также факторы, модифицирующие ДНК, например, 5-бромдезоксиуридин, ускоряют процесс старения экспериментальных животных (1, 8). При этом молекулярные, цитологические и цитогенетические нарушения при естественном, и индуцированном радиацией старении аналогичны (3). В третьих - имеется определенный параллелизм между отдаленными соматическими, (т.е. возникающими непосредственно у облученных организмов) и генетическими, (т.е. наблюдаемыми у потомства облученных родителей), эффектами радиации (5). Это - увеличение канцерогенного риска, нестабильность генома, ухудшение общефизиологического статуса (4, 27, 28). В отличие от самих облученных организмов их потомство свободно от следов непосредственного лучевого воздействия, но так же, как и облученные особи, несёт в своих соматических клетках индуцированные генетические повреждения, переданные через половые клетки родителей. Наконец, при исследовании различных цитогенетических, мутационных и молекулярно-генетических нарушений в большинстве случаев было установлено, что их частота увеличивается с возрастом. Это касалось хромосомных аберраций (13, 17), микроядер (12), анеуплоидий (15), утраты теломерных повторов (21), мутаций в гликофориновом локусе (14), мутаций устойчивости к 6-тиогуанину (19), разрывов ДНК (2) и др. Структурные аберрации хромосом относятся к тому типу генетических нарушений, которые, несомненно, вносят свой вклад в многофакторный процесс старения. Нестабильные хромосомные аберрации - дицентрики, кольца, фрагменты - приводят к гибели клеток, стабильные - транслокации, инсерции, как известно, сопровождают онкогенез, а также могут влиять на жизненно важные функции клеток. Показанное в многочисленных исследованиях увеличение частоты структурных мутаций под влиянием различных вредных факторов (радиация, химические соединения) позволяет рассматривать их как одну из возможных причин ухудшения здоровья людей в экологически неблагоприятных условиях. В настоящей работе была исследована возрастная динамика частоты стабильных и нестабильных аберраций хромосом у людей в норме (контрольная группа), а также у лиц, подвергшихся аварийному воздействию ионизирующей радиации в малых дозах (экспонированная группа). Для анализа хромосомных аберраций использовали молекулярно-цитогенетический метод флуоресцентной in situ гибридизации (FISH), широко применяемый в последнее время в цитогенетических исследованиях (22) и имеющий ряд преимуществ по сравнению с существовавшими ранее (рутинный, бэндирование). Он обладает большей разрешающей способностью, поскольку цветовые различия хромосом позволяют регистрировать мелкие перестройки, не идентифицируемые другими методами; меньшей трудоемкостью, т.к. верификация хромосомных аномалий достаточно проста и не требует высокой квалификации исследователя. В результате статистическая достоверность полученных этим методом результатов существенно повышается. МАТЕРИАЛ И МЕТОДЫ. Экспонированная группа состояла из 45 человек и включала ликвидаторов аварии на ЧАЭС; людей эвакуированных с территорий, загрязненных радионуклидами; участников испытаний атомного оружия на Семипалатинском полигоне; рабочих Челябинского атомного предприятия "Маяк". Все эти люди испытали радиационное воздействие в малых дозах, хотя точные значения доз, как правило, были неизвестны. Возраст обследованных колебался от 6 лет до 71 года. Время, прошедшее после облучения варьировало от 1 до 40 лет. Контрольная группа состояла из 32 человек в возрасте от 3 до 67 лет, согласившихся сдать кровь для цитогенетического анализа. Детей обследовали с согласия родителей, присоединяясь к плановому забору крови в лечебных учреждениях. На каждого человека заполняли анкету, включавшую данные о возрасте, вредных привычках (курение, алкоголь), характере облучения (для экспонированной группы), а также болезнях, приеме лекарств, рентгенодиагностических процедурах в течение полугода, предшествовавшего цитогенетическому обследованию. Кровь брали из локтевой вены в стерильные вакутейнеры с антикоагулянтом и культивировали в среде RPMI-1640 с эмбриональной сывороткой, ФГА, L-глутамином и антибиотиками при температуре 370С в течение 48-52 часов, последние 3 часа - в присутствии колцемида (0,1 мкг/мл) для накопления лимфоцитов на стадии метафазы. Для каждого человека ставили несколько параллельных культур. Препараты метафазных лимфоцитов готовили общепринятым способом, используя для гипотонической обработки клеточной суспензии 0,55% раствор КСl (14 мин., 370С), для фиксации - смесь метанола с ледяной уксусной кислотой в объемном соотношении 3:1. Подробнее процедуры постановки и снятия культуры описаны ранее (6). Для выявления хромосомных аберраций как стабильного (транслокации, инсерции), так и нестабильного (дицентрики, кольца, фрагменты) типов использовали метод флуоресцентной in situ гибридизации (FISH) метафазных хромосом с ДНК-зондами, специфическими к 1, 4 и 12 хромосомам человека и к центромерным районам. Хромосомные зонды, меченные биотином, были получены нами с помощью ник-трансляции или ПЦР из ДНК, выделенной из плазмидных библиотек (рBS, Hind III), любезно предоставленных профессором J.W.Gray (Сан-Францисcкий Университет). Панцентромерную пробу, меченную дигоксигенином, получали по описанному методу (30). Гибридизацию препаратов и постгибридизационные отмывки проводили в соответствии с протоколом, описанным в работе (9). Связавшиеся с хромосомами ДНК-зонды выявляли путем последовательных обработок препаратов FITC-стрептавидином и биотинилированным антистрептавидином. Для детекции центромерных районов использовали антитела, меченные АМСА (метилкумарин-3-уксусная кислота). Для контрастного окрашивания остальных хромосом применяли пропидиум йодид (PI) в растворе, предотвращающем быстрое выцветание флуорохромов (FITC и АМСА) под ультрафиолетовым светом. Препараты анализировали под ультрафиолетовым микроскопом "Axioplan" (Cаrl Zeiss), используя набор фильтров для визуализации FITC (желтый), PI (красный) и АМСА (голубой) флуорохромов. В результате FISH-гомологичные пары 1, 4 и 12 хромосом выявлялись как желтые (FITC) структуры на фоне остальных-красных (PI), центромеры светились голубым цветом (АМСА). Обмены участками между по-разному окрашенными хромосомами приводили к появлению двуцветных хромосом, которые легко идентифицировались как транслокации (реципрокные или терминальные) или дицентрики по количеству центромер. Бесцентромерные структуры (одноцветные или двуцветные) регистрировали как ацентрические фрагменты. Поскольку при FISH анализе учитываются только обмены между разноцветными хромосомами, для расчета геномной частоты событий использовали формулу: FG=Fp/2fp(1-fp) (23), где Fp - частота аберраций с участием хромосом-мишеней, fp - доля генома, которую составляет ДНК этих хромосом (24). Для хромосом 1, 4, 12 она равна 0,19. На каждого человека анализировали не менее 1000 клеток. Данные обрабатывали с помощью регрессионного анализа, подбирая методом наименьших квадратов для каждого типа аберраций (транслокаций и дицентриков) наиболее подходящую модель зависимости частоты событий от возраста донора. Вероятность отличий оценивали с помощью t-критерия Стъюдента. РЕЗУЛЬТАТЫ. Для удобства представления результатов исследованная возрастная шкала была разбита на 10-летние интервалы, средние значения частот хромосомных аберраций по каждому интервалу представлены в таблице. Видно, что с возрастом частота транслокаций увеличивается. Частота хромосомных обменов у людей разных возрастных групп
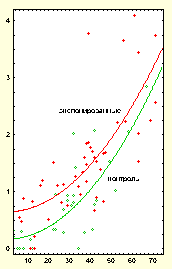
Регрессионный анализ показал, что возрастная динамика частоты стабильных хромосомных обменов в контрольной группе (Рис. 1) удовлетворительно описывается квадратичной функцией Y=(0,170+/-0,118)+(0,00054+/-0,00008)*X2, где Y - частота транслокаций на 100 клеток, Х - возраст в годах. По сравнению с частотой стабильных аберраций, наблюдаемой у детей в возрасте 3 года, у людей, достигших 50 и более лет, она увеличилась в 10-15 раз, при этом до 29 лет - незначительно, а после 30 - резко. Средние частоты транслокаций в этих двух группах составили 0,111+/-0,047 и 1,967+/-0,529 соответственно (р<0,01). Неравномерность увеличения частоты транслокаций во времени наблюдали и авторы тех двух работ, где также методом FISH была исследована зависимость возраст-эффект для хромосомных аберраций стабильного и нестабильного типов (25, 26). Однако, в американской контрольной выборке возраст, при котором резко увеличился уровень транслокаций, составил 50 лет. Среди лиц контрольной группы в нашем исследовании встретилось 2 человека, которые характеризовались слишком высокими для своего возраста частотами транслокаций. Они принадлежали к одной семье (отец и дочь) и профессионально не были связаны с ионизирующими излучениями. Дополнительное исследование с помощью G-бэндирования хромосом может помочь установить, не являются ли эти транслокации клоновыми. Возможно также, необходимо провести более тщательное анкетирование этих людей и обследование других членов семьи. При построении кривой возраст-эффект результаты по этим людям были исключены. Аналогичные `аутсайдеры` были описаны и в работе (26), у этих людей были обнаружены клоновые транслокации.
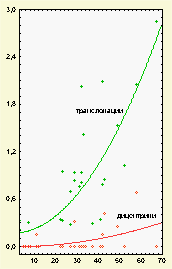
Дицентрические хромосомы, будучи летальными для клеток, постоянно элиминируют, а транслокации сохраняются в процессе пролиферации клеток-предшественников лимфоцитов. Низкая частота дицентриков является, по-видимому, причиной того, что данные об их возрастной динамике, полученные рутинным методом, при котором анализируется, как правило, 100-200 клеток, противоречивы (13, 20). В то же время в упоминавшихся уже работах (25, 26), где использовали FISH-метод и оценивали по 2000 метафаз, показана четкая зависимость количества дицентриков от возраста донора. Она, так же как и в нашем исследовании, удовлетворительно описывалась уравнением как линейной, так и квадратичной зависимости. Для удобства сопоставления с транслокациями мы выбрали квадратичную модель, соответствующую уравнению: Y=(-0,003+/-0,037)+ (0,00006+/-0,000025)*X2, где Y - частота дицентриков на 100 клеток, X - возраст в годах. Кривая, соответствующая этому уравнению, представлена на рисунке 1. Данные о частоте транслокаций и дицентриков в экспонированной группе также представлены в таблице. При сопоставлении с результатами контрольной группы у лиц, испытавших лучевое воздействие, можно отметить повышенный уровень обоих типов хромосомных обменов. В отличие от транслокаций, по дицентрикам в экспонированной группе не выявлено возрастной зависимости, хотя в интервале от 6 до 39 лет она наблюдается. Возможно, причиной этому является недостаточный объём выборок исследуемых, при котором результаты по одному-двум `выпадающим` случаям могут отразится на средних значениях. Учитывая неоднородность экспонированной выборки людей по типам радиационных воздействий, величинам доз, времени, прошедшему после облучения, сравнение возрастной зависимости хромосомных аберраций в ней с контрольной группой можно провести лишь условно. Тем не менее, как видно из рисунка 2, кривая возраст-эффект для транслокаций в этой группе проходит выше соответствующей контрольной кривой. Она описывается уравнением квадратичной функции вида Y=(0,650+/-0,156)+(0,00052+/-0,00007)*X2 , где Y - частота транслокаций на 100 клеток, Х - возраст в годах. По-видимому, радиационное воздействие добавило к возрастному уровню стабильных хромосомных аберраций каждого человека некую величину (определяемую сценарием облучения), что и составило в целом по группе прирост количества хромосомных аберраций по сравнению с контролем. ОБСУЖДЕНИЕ В экспериментах на мышах возрастное увеличение частоты хромосомных поломок впервые было продемонстрировано в 60-х годах Сurtis H. на постмитотических клетках-гепатоцитах, искусственно стимулированных к делению (10). Это положило начало исследованию роли хромосомных аберраций в старении. Существует несколько типов цитогенетических нарушений, роль которых в канцерогенезе в настоящее время активно обсуждается (27). Это - хромосомные аберрации, микроядра, анеуплоидия, сестринские хроматидные обмены. Структурные аберрации хромосом рассматриваются как наиболее вероятные события, связанные с малигнизацией. Эта связь подтверждается тем, что подавляющее большинство новообразований характеризуется теми или иными хромосомными перестройками; тем, что большинство канцерогенов индуцируют структурные аберрации хромосом; тем, что мутации в генах, ответственных за репарацию ДНК, за супрессию онкогенов, за контроль клеточного цикла увеличивают как частоту опухолей, так и частоту хромосомных поломок. Недавнее исследование группы скандинавских авторов, обследовавших несколько тысяч людей и показавших, что риск возникновения рака возрастает у лиц с повышенным спонтанным уровнем хромосомных нарушений, можно расценивать как эпидемиологическое доказательство роли хромосомных аберраций в канцерогенезе (16). Известно, что в старости вероятность развития опухолей увеличивается, поэтому
анализ возрастной динамики хромосомных аберраций может способствовать
пониманию механизмов
канцерогенеза.
Как следует из представленных результатов, значительное возрастное увеличение уровня хромосомных аберраций наблюдается лишь в отношении транслокаций, но не дицентриков. Это связано с разными механизмами их реализации в процессе деления предшественников лимфоцитов. Создавая определенный дисбаланс в клетках в результате утраты части генетического материала, нестабильные хромосомные аберрации (дицентрики, кольца, фрагменты) приводят к гибели клетки и, таким образом, постоянно подвергаются элиминации. В тканях с ограниченной пролиферативной активностью это может приводить к невосполнимой утрате специализированных клеточных элементов и создавать основу для размножения менее дифференцированных клеток. Стабильные аберрации хромосом (транслокации, инверсии и инсерции), будучи не летальными для клеток, напротив, персистируют в ряду клеточных поколений, могут накапливаться с возрастом и при действии генотоксикантов давать начало потенциально опухолевым клонам. Квадратичный характер зависимости частоты этих аберраций от возраста позволяет предположить, что при старении происходит не просто накопление поломок в силу того, что организм дольше подвергается действию генотоксических факторов. По-видимому, с возрастом ухудшаются процессы репарации ДНК (31) и/или увеличивается ее повреждаемость (2). Значительно менее выраженное, однако, достоверное возрастное увеличение частоты дицентриков, которые, как было отмечено выше, не накапливаются в делящихся клетках, может свидетельствовать о развивающейся с возрастом нестабильности хромосом и, поэтому, большей их чувствительности к генотоксическим воздействиям окружающей среды. Следует отметить, что повышение чувствительности лимфоцитов пожилых людей к действию цитозинарабинозида было показано в работе Кулешова Н.П. (7). Увеличивающаяся генотоксичность окружающей среды все настоятельнее ставит задачу изучения возможных негативных последствий этого процесса для здоровья людей и оценки риска, в частности, канцерогенного. Поскольку хромосомные аберрации индуцируются теми же воздействиями, что и рак, поскольку они встречаются в большинстве опухолей, а иногда и определяют её клинический прогноз (как, например, в случае лейкемии) некоторые авторы (15, 27) предлагают использовать их в качестве маркера (суррогата) опухоли в расчётах онкологического риска. Это особенно важно для экстраполяции кривой доза-эффект по выходу опухолей в область малых уровней воздействий, когда их встречаемость низка и для регистрации необходимы колоссальные эпидемиологические исследования. Как показали наши исследования на ограниченной группе людей, подвергшихся облучению в небольших дозах (Рис. 2), все они характеризуются повышенным по сравнению со своей возрастной нормой уровнем стабильных хромосомных аберраций независимо от того, когда и по какому сценарию произошло лучевое воздействие. Эти лица, по-видимому, должны быть отнесены к группе повышенного онкологического риска а, возможно, и других негативных последствий для здоровья. Исследование возрастной динамики стабильных хромосомных аберраций имеет и ряд практических аспектов. Имея достоверную (т.е. полученную на большом статистическом материале) калибровочную кривую возраст-эффект, можно определять `биологический возраст` человека и, следовательно, реальный, а не календарный риск развития у него той или иной патологии; выявлять `аутсайдеров`, т.е. лиц с достоверно более высокими частотами хромосомных аберраций по сравнению с нормой для данного возраста, чтобы затем обследовать их более детально на наличие клонов аберрантных клеток; проводить более корректную биодозиметрию ионизирующих излучений и других генотоксикантов по частоте стабильных хромосомных аберраций с учетом их возрастного накопления. ЛИТЕРАТУРА
Рис.1 Рис.2 Подписи к рисункам. Рис.1 Зависимость частоты транслокаций и дицентриков от возраста у людей контрольной группы.
по оси абсцисс-
количество аберраций на 100 клеток
Рис.2 Сравнение зависимости частоты транслокаций от возраста у людей контрольной и экспонированной групп.
по оси абсцисс-
количество транслокаций на 100 клеток
Abstract. Vorobtsova I., Timofeyeva N., Bogomasova A., Semyonov A. Age-response of stable chromosome aberrations detected by FISH in lymphocites of healthy donors and people exposed to accidental irradiation in low doses. Central Research Institute of Roentgenology and Radiology, St.Petersburg, Russia Age-response of stable chromosome aberrations in cultivated human lymphocytes was studied in control population (32 persons) and in people survived accidental radiation exposure in low doses (45 persons). For visualisation of chromosomal exchanges `chromosome painting` based on FISH technique was performed using DNA probes specific to chromosomes 1,4 and 12. At the age range from 3 years to 70 years about 15 - 20 fold increase of stable chromosome aberration (translocation) level was found in lymphocytes of healthy donors. The frequency of unstable chromosomal exchanges (dicentrics and rings) also grows by age, but much slower. Age response of both stable and unstable chromosomal exchanges fit well the square model and it means that diminished DNA repair ability contribute to accumulation of chromosomal damages with senescence. The number of stable chromosome aberations in exposed people was higher than in matched by age control group. The data obtained provide supportive evidence that stable chromosome aberrations accumulate with age and persist for a long time after radiation exposure.The possibility to use stable cromosome aberration as a marker of cancer for assessment of carcinogenic risk is discussed.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006 Свидетельство о регистрации сетевого электронного научного издания N 077 от 29.11.2006
Свидетельство о регистрации сетевого электронного научного издания Медлайн.Ру - N 227 от 20 октября 2008 года.
Выдано ФГУП "Информрегистр" Журнал основан 16 ноября 2000г.
Выдано Министерством РФ по делам печати, телерадиовещания и средств массовых коммуникаций
(c) Перепечатка материалов сайта Medline.Ru возможна только с письменного разрешения редакции
|
|
| Размещение рекламы | |
|
| |

 Articles
Articles
 Как видно из таблицы, частота дицентриков во всех возрастных интервалах на порядок
ниже, чем частота транслокаций, и с возрастом увеличивается
значительно медленнее. Хотя эти два типа хромосомных обменов
теоретически возникают с одинаковой частотой, их дальнейшая судьба в
клеточных популяциях различна.
Как видно из таблицы, частота дицентриков во всех возрастных интервалах на порядок
ниже, чем частота транслокаций, и с возрастом увеличивается
значительно медленнее. Хотя эти два типа хромосомных обменов
теоретически возникают с одинаковой частотой, их дальнейшая судьба в
клеточных популяциях различна.