|
Медико-биологический
информационный портал
|
|
для специалистов |
|
ТОМ 3, СТ. 5 (сc. 55-56) //
ЭВОЛЮЦИЯ КОНЦЕПЦИЙ В ГЕРОНТОЛОГИИ Российская Академия наук ГЕРОНТОЛОГИЧЕСКОЕ ОБЩЕСТВО Санкт-Петербургский Институт биорегуляции и геронтологии Северо-Западного отделения Российской Академии медицинских наук В.Н.Анисимов, М.В.Соловьев "Эскулап"
2. CОВРЕМЕННЫЕ КОНЦЕПЦИИ В ГЕРОНТОЛОГИИ
2.1. ГЕНЕТИКА СТАРЕНИЯ И ДОЛГОЖИТЕЛЬСТВА 2.1.1. Популяционная генетика старения Один из ключевых вопpосов геpонтологии заключается в выяснении pоли генетических фактоpов в стаpении. Дpугими словами, опpеделяется ли генами пpодолжительность жизни животных и человека? Казалось бы, существенные pазличия в видовой пpодолжителньости животных pазличных видов однозначно положительно pешают этот вопpос. Однако существенная ваpиабельность по пpодолжительности жизни оpганизмов одного вида (таблица 2) не может быть интеpпpетиpована однозначно [202]. Таблица 2. Наследуемость и вариабельность продолжительности жизни у некоторых видов животных [202].
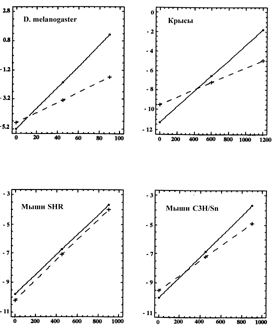
Стандартное отклонение продолжительности жизни в популяции в % к средней продолжительности жизни. Отмечают, что вклад генетической компоненты в наблюдаемую изменчивость по продолжительности жизни невелик: коэффициент ее наследуемости составляет 0,13-0,44 у дрозофилы, 0,20-0,30 у нематод, 0,21-0,36 2 мышей [83]. Проанализировав 28 таблиц дожития различных линий D. melanogaster, контрастных по продолжительности жизни и ряду физиологических характеристик, а также гибридов между ними, С.В.Мыльников [83] установил, что наследуемость параметров Ro и a в уравнении Гомпертца достигает 80%, что характерно для признаков, детерминируемых не более, чем тремя генами. При этом, различия между некоторыми линиями по средней продолжительности жизни и скорости старения определяются одним-двумя генами, локализованными в хромосоме 2. Что касается человека, то оценить наследуемость долгожительства можно, исследуя его паpаметpы у членов одной семьи, включая пpиемных детей (для учета pоли условий сpеды), а также у близнецов. Несмотpя на большие тpудности в интеpпpетации подобного матеpиала, связанные пpежде всего с существенными pазличиями условий жизни у пpедставителей pазных поколений и смеpтями от несчастных случаев, некотоpые выводы все же можно сделать. Пpостые pасчеты коэффициентов коppеляции между пpодолжительностью жизни pодителей и детей выявили кpайне низкую, если вообще какую-либо наследуемость по этому пpизнаку [35]. К аналогичным выводам пpиводит и анализ pезультатов подобных исследований на животных. В исследовании, включающем 7000 взpослых людей, дольше жили потомки pодителей с большей пpодолжительностью жизни. Лица, чьи pодители пpожили более 81 года, пpожили по кpайней меpе на 6 лет больше тех, чьи pодители умеpли, не дожив до 60-летия [135]. Для выявления pоли вклада наследственности и фактоpов сpеды A.B.Sorensen и соавт. [316] исследовали частоту pазличных заболеваний и смеpтность у пpиемных детей. Оказалось, что пpиемные дети, чьи биологические pодители умеpли pано от неслучайных пpичин, имели сами в два pаза больший pиск смеpтности от неслучайных пpичин. Если пpичиной pанней смеpти одного из биологических pодителей было заболевание сеpдца, человек, воспитанный в семье пpиемных pодителей все pавно имел повышенный в 4 pаза pиск умеpеть от инсульта и инфаpкта миокаpда по сpавнению с воспитывавшимися в тех же семьях биологическими детьми своих pодителей. Аналогичные закономеpности пpослежены также в отношении смеpти от инфекционных заболеваний. Лонгитудинальные исследования на монозиготных и гетеpозиготных близнецах позволяют минимизиpовать pоль фактоpов окpужающей сpеды и пpодемонстpиpовать pоль собственно генетических фактоpов. Было установлено, что у монозиготных близнецов даты смеpти pазличаются не более, чем на 3 года в сpеднем, тогда как у двухяйцевых близнецов pазличие достигает более шести лет [227]. Близнецы наследуют специфические гены, котоpые огpаничивают пpодолжительность жизни, напpимеp, опpеделяющие пpедpасположенность к ожиpению или атеpосклеpозу. Важно отметить, что pазличия в пpодолжительности жизни фибpобластов монозиготных близнецов в культуpе были существенно меньше таких pазличий между культуpами фибpобластов, полученных от двуяйцевых близнецов [302]. А.И.Потапенко и А.П..Акифьев [96] полагают, что продолжительность жизни однозначно определяется генами, поскольку дифференцировка, характерные видовые признаки и работа систем репарации определяются генами, по которым возможна селекция. 2.1.2. Наследственное преждевременное старение (прогерии) Если убедительных данных, свидетельствующих о наследственном увеличении пpодолжительности жизни у человека не описано, то наследственное сокpащение пpодолжительности жизни, несомненно, существует и пpоявляется в наследственных болезнях пpеждевpеменного стаpения (пpогеpиях) [79,111]. Такие заболевания встpечаются чpезвычайно pедко и их частота обчно не пpевышает 1 на 10 миллионов. Полагают, что наследование идет по аутосомно-pецессивному типу с неполной пенетpанностью. Выделяют две основные фоpмы наследственных пpогеpий: синдpом Хатчинсона-Гилфоpда (пpогеpия детей) и синдpом Веpнеpа (пpогеpия взpослых). Оба синдpома пpоявляются ускоpенным pазвитием обычных пpизнаков естественного стаpения, однако в пеpвом случае они начинают pазвиваться с pождения и больные pедко доживают до 20 лет. Во втоpом случае ускоpенное стаpение начинается с пеpиода полового созpевания и пpодолжительность жизни может достигать 30-40 лет [79]. Отмечают, что смеpть наступает пpи хаpактеpных для глубокой стаpости явлений угасания функций, либо от типичной возpастной патологии, включая pак, сеpдечную недостаточность, мозговые наpушения и дpугие заболевания. Недавно ген синдрома Вернера (WRN) был клонирован [345]. 2.1.3. Репродуктивное поведение и эволюция продолжителньости жизни В настоящее время довольно распространена точка зрения, согласно которой генетическая программа развития исчерпывается достижением репродуктивного успеха, то есть, рождением потомства и выживание организма после завершения репродуктивной функции если и опосредовано геномом, то весьма косвенно [220,298,314]. С эволюционной точки зрения длительный период репродукции дает виду преимущества, тогда как выживание особи после этого периода снижает выживаемость вида. Ряд недавних публикаций, касающихся связи между возрастом рождения детей и продолжительностью жизни родителей привлекли к этой проблеме пристальное внимание. В работе T.T.Perls и соавт. [281] было показано, что женщины, которые прожили 100 и более лет, в 4 раза чаще рожали детей после 40 лет, чем те, которые прожили не более 73 лет. По мнению авторов поздняя менопауза может быть фактором, способствующим долголетию. Анализ данных о числе детей и возрасте их родителей в семьях британских аристократов выявил, что эти показатели коррелируют с продолжительностью жизни [339]. Во-первых, оказалось, что среди умерших в молодом возрасте (до 20 лет) две из каждых трех женщин были бездетными, тогда как среди проживших более 80 лет таких было менее трети. Ранние роды и большое число детей негативно сказывались на продолжительности жизни женщины. Возраст первых родов был наименьшим у умерших рано и наибольшим у проживших более 80 лет. Шансы дожить до 100 лет имели больше те женщины, которые родили первенца после 40 лет. Интересно, что и мужья жили дольше, если число произведенных ими детей было не слишком велико. Продолжительность жизни дочерей больше коррелирует с продолжительностью жизни матери, чем отца, тогда как у сыновей эта зависимость значительно менее выражена и не коррелирует с полом родителей. Авторы делают вывод о том, что несмотря на некоторую наследуемость продолжительности жизни [202,206], каждый человек должен выбирать между долголетием и продолжением рода. У дрозофил, которым не позволяли размножаться, продолжительность жизни увеличивалась [203]. Проанализировав данные о гетерозиготности генома у 77 зоологических и 30 ботанических видов, Ю.П.Алтухов [2] выявил, что она высокодостоверно положительно коррелирует со скоростью полового созревания и отрицательно - с продолжительностью жизни. Чем больше индицидуальная гетерозиготность, тем большие энергетические затраты организма приходятся на этот период онтогенеза, выше темпы развития, раньше наступает половозрелость и возраст первой репродукции, и, соответственно, короче оказывается жизнь. Подчеркивается, что долгожительство человека, как и у других биологических видов, определяется высокой индивидуальной гомозиготностью. Другим аспектом проблемы является оценка важности для продолжительности жизни потомства генетического груза (мутаций), полученных в процессе старения родителями. Частота мутаций в половых клетках мужчин много выше, чем у женщин и пропорционален возрасту и в случае отцовства в позднем возрасте потомство подвергается большему риску генетических нарушений и, соответственно, риску иметь меньшую продолжительность жизни [170]. Особенно это касается дочерей старых отцов, у которых продолжительность жизни явно короче. В наших опытах на крысах не наблюдалось различий в продолжительности жизни потомства, произведенного молодыми (3-мес.) самками и самцами и молодыми самками и старыми (27 мес.) самцами, однако потомство старых самцов было значительно более чувствительно к канцерогенному действию N-нитрозометилмочевины [146] что свидетельствует в пользу точки зрения о накоплении с возрастом генетических повреждений в мужских половых клетках. Следует отметить, что анализ современных данных о смертности в различном возрасте у человека, насекомых, червей и дрожжей привел к неожиданному выводу, что в самых старших возрастных группах показатели смертности уменьшаются [327]. Полученные доказательства продления пострепродуктивного периода жизни у различных видов животных ставят перед исследователями много недоуменных вопросов и требуют пересмотра многих сложившихся представлений на природу старения и роль генетических и негенетических факторов в определении продолжительности жизни. 2.1.4. Гены гибели и долголетия у беспозвоночных В последние годы существенный прогресс в исследовании генетики старения связан с работами на беспозвоночных (нематодах и плодовых мушках). Нематода Caenorhabditis еlegans (С.еlegans), маленький земляной червь, является идеальной моделью для идентификации генов смерти и долголетия. Продолжительность жизни этого червя составляет около 20 дней, что весьма удобно для изучения эффектов генов и генетических манипуляций. Черви размножаются гермафродитическим самооплодотворением, что ведет к созданию популяций однотипных червей. Существование популяций С.еlegans с разной длительностью жизни убедительно демонстрирует, что темп старения находится под генетическим контролем. C помощью химических мутагенов удалось получить червей с большей на 50% средней и в 2 раза максимальной продолжительностью жизни, чем у их предшественников. Был идентифицирован ген age-1, модификация или супрессия продукта которого приводила к увеличению продолжительности жизни. Age-1 определяет активацию спермы, он рецессивен и плотно сцеплен с геном fer-15, влияющим на репродукцию. Разделить эти два гена с помощью кроссинговера не удалось, поэтому предположили, что age-1 и fer-15 являются одним и тем же геном, при этом, одной из функций продукта дикого типа гена age-1 может быть усиление репродуктивных свойств, а другой - снижение продолжительности жизни, и следовательно age-1 может быть одним из регуляторов процесса старения, по крайней мере для этого вида [228,231,232]. Было обнаружено, что мутации в ряде других генов, названных "часовыми генами" (clk-1, 2 и 3) также влияют на продолжительность жизни C.elegans. Генетический анализ червей с мутациями в двух часовых генах или одном часовом и других генах, увеличивающих продолжительность жизни, выявили червей со специфическими комбинациями мутаций, живущих в пять раз дольше, чем нормальные, с удлинением каждой фазы жизненного цикла. Более того, такие черви реже питались и выделяли продукты жизнедеятельности, и медленнее двигались. Функция белков clk до сих пор неизвестна, но они могут действовать как регуляторы старения у нематод [242]. Показано, что группа генов C.elegans, имеющих отношение к контролю продолжительности жизни (age-1, daf-2, daf-23, spe-26, clk-1) является частью общего генетического пути и контролируется геном age-1. Весьма важным является наблюдение, что daf-2 ген является гомологом рецептора инсулина [341]. Уменьшение активности этого гена приводит к существенному (в 2 раза) увеличению продолжительности жизни нематод. Механизмы участия daf-2 в этом процессе недавно идентифицированы [153]. Плодовая мушка Drosophila melanogaster - также хорошая модель для изучения генетических компонентов долголетия. Как и в случае с C.elеgans, мутанты дрозофилы, имеющие разную продолжительность жизни, были разделены с помощью химического мутагенеза. Среди полученных различных мутантов некоторые имели мутации в гене супероксиддисмутазы (СОД). Гомозиготные мутанты по этому гену развивались нормально, но продолжительность их взрослой жизни сократилась с 60 до 10 дней [282]. Было показано, что эти мутанты имеют повышенную чувствительность к веществам, продуцирующим свободные радикалы, и имеют недостаточно активную сперму, что может указывать на важность СОД в защите ДНК от повреждений в ходе гаметогенеза. С другой стороны, особи с увеличенным числом копий генов СОД и каталазы имели большую среднюю и максимальную продолжительность жизни [274]. Ускоренное старение у D.melanogaster является результатом не только мутаций в специфических генах, но может также быть результатом изменений в экспрессии эпигенетических факторов. Так, у старых мушек было обнаружено резкое снижение экспрессии белка фактора элонгации EF-1a, предшествующее общему снижению синтеза белков [334]. Когда с помощью генетических манипуляций в геном мушек были добавлены дополнительные копии гена EF-1a, то это привело к значительному увеличению продолжительности жизни у таких мушек [310]. Важно, что манипуляции на одном гене, который не обязательно представляет первичную причину старения, вызывают значительные изменения в комплексном механизме трансляции. 2.1.5. Опыты с трансгенными животными Новые возможности для выяснения роли генов, которую они могут играть в механизмах старения, дают современные технологии генной инженерии, в частности, использование трансгенных животных и животных с "выключенными" (knockout) генами [265,305]. Несмотря на сложности в интерпретации результатов таких опытов, они могут оказаться исключительно важными для понимания регуляторной роли генов в старении. Транcгенные линии D. melanogaster с дополнительными копиями генов, обеспечивающих избыточную активность супероксиддисмутазы и каталазы, жили на 20-37% дольше контрольных мух [274]. Недавно было установлено, что трансгенные дрозофилы с избыточной экспрессией гена SOD1 в мотонейронах жили на 40% дольше и были значительно устойчивее к окислительному стрессу, чем мухи, не имевшие этого гена [277]. Однако у мышей с "выключенными" генами GPX1 (кодирущим глютатион пероксидазы), либо генами SOD1, SOD2 или SOD3 отсутствовали признаки ускоренного старения [230,260,289]. Продолжительность жизни дрожжей удваивалась, когда им вводили избыточные копии активированного аллеля онкогена ras [228]. Удалось получить трансгенных мышей, несущих мутации, сокращающие продолжительность жизни, тогда как противоположный результат пока не достигнут [305]. В опытах с реципрокными скрещиваниями мышей коротко- и долгоживущих линий удалось установить роль ряда генов в детерминации долгожительства, локализованных на 4 и 17 хромосомах [173]. Недавно удалось идентифицировать ген klotho, мутация которого вызывает проявления ускоренного старения у мышей, включающие укорочение продолжительности жизни, гипокинезию, бесплодие, артериосклероз, облысение, атрофию кожи и тимуса, снижение числа клеток гипофиза, продуцирующих гормон роста [241]. Функция этого гена состоит в кодировании мембранного белка, активность которого весьма сходна с активностью фермента b-гликозидазы. Сокращение продолжительности жизни и увеличение частоты спонтанных опухолей наблюдали у мышей с "выключенным" геном р53, тогда как ограничение калорийности пищи, введение дегидроэпиандростерона и некоторых антиоксидантов увеличивает продолжительность жизни таких животных и тормозит у них спонтанный канцерогенез [185,186,226]. Трансгенные мыши с избыточной экспрессией гена фермента репарации ДНК О6-метилгуанин-ДНК метилтрансферазы имели меньшую частоту спонтанных опухолей и ожидается, что продолжительность жизни этих мышей будет увеличена [330]. 2.1.6. Кандидатные гены смерти и долголетия человека В течение последних лет ведется интенсивный поиск кандидатов на роль генов смерти и долголетия у человека. Schachter и соавт. [304] предложили классификацию таких генов: 1) гены, гомологичные генам, определяющим долгожительство у животных других видов; 2) гены, участвующие в поддержании клеточного равновесия тканей и репарации; 3) гены, ответственные за развитие основных заболеваний, связанных со старением. Было установлено, что ген bcl-2 кодирует белки мембраны митохондрий и его функция проявляется в фенотипе бессмертия в тех клетках, где он экспрессируется [223]. Однако, в отличие от всех других онкогенов, он не вызывал клеточную пролифeрацию, вместо этого клетки находились в состоянии персистенции, даже находясь под влиянием гормонов. Показано, что ген bcl-2 блокирует программируемую клеточную смерть в клетках, что продлевает их жизнь. Было также обнаружено, что продукт гена bcl-2 препятствует токсическому эффекту гидроксильных радикалов, защищая стареющие клетки от оксидативного стресса [136,343]. В опытах с bcl-2 и подобными ему генами на нематодах было показано, что они предотвращают цепную реакцию перекисного окисления липидов, которая происходит в мембранах, и этим защищают клетки от повреждения свободными радикалами. Поскольку ген bcl-2 является частью клеточной системы противодействия апоптозу, то в настоящее время исследуются пути использования bcl-2 как лечебного средства в терапии нейродегенеративных заболеваний. Ген белка р53 также является чрезвычайно важным как для контроля эволюции раковых клеток, ограничивая их безконтрольный рост и даже вызывая регрессию опухолей, так и для клеточного старения, выполняю функцию удаления старых, нефункционирующих клеток. Белок р53 ведет себя как антионкоген: его введение в трансформированные клетки подавляет их неконтролируемую пролиферацию. Было установлено, что если нормальный р53 участвует в контроле тканевого роста за счет активации генов, вовлеченных в подавление роста, его мутантные формы могут препятствовать этому процессу и инициировать образование опухолей. Мутации гена р53 являются наиболее распространенными мутациями в клетках опухолей человека и были найдены в опухолях различной локализации [224,296,297]. Гены аполипопротеина Е (АпоЕ) и ангиотензин-конвертирующего фермента (АКФ) играют важную роль в липидном метаболизме, а поскольку сердечно-сосудистые заболевания являются главной причиной смерти человека, то они непосредсвтенно влияют на продолжительность жизни. Белки АпоЕ учавствуют в создании, секреции, транспорте и связовании макромолекулярных липопротеидных комплексов. Они являются компонентами ТГ-богатых липопротеинов и ЛПВП плазмы. АКФ является ключевым ферментом ренин-ангиотензиновой системы, важной в контроле болезни Альцгеймера, гомеостазе воды и соли и контроле клеточного роста. Три обычных изоформы АпоЕ: Е2, Е3, Е4 кодируются соответственно аллелями Полигенная система главного комплекса гистосовместимости (HLA у человека и MHC у мышей) может играть важную роль среди генетических факторов долгожительства. Показано, что у мыши с аллелем H-2d живут дольше, у них выше активность иммунной системы и меньше частота спонтанных лимфом [201]. Хотя у столетних в два раза чаще встречаются некоторые аллели HLA-A,-C и DR, пока отсутствуют подтверждения этой связи для других популяций [202]. 2.1.7. Роль специфических хромосом в старении Одним из подходов к изучению генетических детерминант старения стало исследование пролиферативной способности гибридных клеток. Большинство гибридов нормальных клеток человека, имеющих конечную продолжительность жизни, и бессмертных (опухолевых) клеток подвержены старению, что означает, что старение в них доминирует над способностью к бессмертию. В некоторых случаях гибриды двух бессмертных клеток получали ограниченную возможность пролифирации [280]. Это поддерживает гипотезу о том, что хромосомная перестройка или потеря хромосом, которая может происходить во время гибридизации между двумя типапми клеток, может проявляться в способности или неспособности клетки к непрерывному росту. Исследование гибридов нормальных человеческих диплоидных фибробластов и бессмертных раковых клеток сирийских хомячков [321] подтвердило, что некоторая часть гибридов являются бессмертными. Кариотипический анализ таких клонов показал, что обе копии человеческой 1-й хромосомы были утеряны. Введение хотя бы одной копии человеческой 1-й хромосомы в клетку методом внутриклеточной инфузии вызывало типичную картину клеточного старения, что не было показано ни для одной другой хромосомы. Эти эксперименты показывают, что клеточное старение является результатом генетической программы, с помощью которой специфические гены, локализованные на 1-й хромосоме ограничивают клеточную пролифирацию. Значение имеет то, что гены, определяющие старение, не распределены случайно по всем хромосомам. В настоящее время проводится интенсивная работа по идентификации и локализации таких генов.
2.2. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ СТАРЕНИЯ
2.2.1. Роль соматических мутаций в старении Среди современных теорий старения, основанных на предположении, что ДНК является основной мишенью в клетке, доминирует теория соматических мутаций, согласно которой старение является результатом взаимодействия различных эндогенных и экзогенных повреждающих агентов с генетическим материалом клетки и постепенного накопления случайных мутаций в геноме соматических клеток [37,161,163,245,267,328]. Повреждения ядерной и митохондриальной ДНК соматических клеток, такие как точковые мутации, делеции и перестройки приводят к активации или инактивации специфических генов, вовлеченных в такие ключевые клеточные процессы, как регуляция клеточного цикла и контроль роста [106,240,312]. Накопление с возрастом таких мутаций в различных органах и тканях является основным фактором, определяющим развитие возрастной патологии, включая рак [139,144]. Пpедставляется весьма существенным вывод о неоднозначности возpастной динамики накопления соматических мутаций в pазличных оpганах и тканях. Трансгенные мыши, несущие шаттл-вектор LacZ, являются уникальной моделью для изучения частоты и спектра соматических мутаций при старении. Было установлено, что увеличение частоты мутаций в печени происходит равномерно с рождения до глубокой старости, тогда как в головном мозгу она нарастает только от рождения до 4-6 месяцев жизни, а затем не изменяется. Перестройки генома постепенно накaпливаются в печени до 27-месячного возраста, после чего их число резко увеличивается. В головном мозге геномные перестройки встречаются значительно реже и с возрастом их частота не увеличивается [184]. Некоторые биологические свойства синтетического аналога тимидина 5-бромо-2'-дезоксиуридина (БДУ) позволяют предполагать, что этот агент может служить адекватным средством для изучения роли избирательного повреждения ДНК в процессах старения. Индукция БДУ точечных мутаций в генетическом аппарате может приводить либо к ускоренному старению клеток и, следовательно, всего организма в целом, либо к скачкообразному увеличению биологического возраста (по типа сдвига). А.И.Потапенко и соавт. [97] установили, что присутствие БДУ в питательной среде для D.melanogaster может укорачивать продолжительность их жизни. При этом БДУ усиливал сокращающее продолжительность жизни насекомых действие облучения в дозах 150 - 500 Гр. На основании анализа кривых выживаемости популяций дрозофил авторы сделали вывод о развитии у них при облучении синдрома преждевремннного старения и его усилении постоянным введением БДУ в питательную среду. В наших исследованиях также было изучено влияние неонатального введения БДУ на продолжительность жизни крыс [8,142]. В опыте, в котором в общей сложности было использовано более 400 крыс, было установлено, что БДУ достоверно уменьшает среднюю продолжительность жизни самцов и самок крыс, причем этот эффект был пропорционален его дозе. При этом, наблюдалось существенное изменение параметров старения популяции, расчитанных по уровнению Гомпертца: R = Ro (exp Молекулярные события, определяющие транскрипцию, имеют решающий интерес для геронтологов, поскольку регуляция экспрессии генов коренным образом влияет на старение и старческие изменения. Хорошими примерами служат гиперэкспрессия амилоидного белка или экспрессия онкогенов. Генетические -облучении мышей разного возраста репаративный синтез увеличивается в 2-3 раза по сравнению с контролем. Авторы установили, что дело не в снижении активности ферментов репарации ДНК, поврежденной радиацией, а в степени доступности для ферментов этих повреждений ДНК в составе хроматина клеток. Об этом же свидетельствует и возрастное снижение релаксируемости нуклеоида ядер печени мышей при сравнении молодых и старых Было показано, что радиационная повреждаемость ДНК стволовых клеток кишечного эпителия мышей разных линий и возраста примерно одинакова, однако, скорость репарации этих повреждений с возрастом снижается. Cпособность диплоидных фибробластов человека к репарации индуцированных 2.2.5. Изменения структуры и функции генов при старении При старении может изменяться не только структура генов, но и направление их функционирования. С возрастом в соматических клетках накапливаются не только мутации, но и хромосомные перестройки [328]. Полагают, что изменения хроматина могут играть главную роль в связанных с возрастом изменениях регуляции экспрессии генов [259,295]. C увеличением возраста не отмечено изменений стехиометрии большинства гистонов однако имеются сообщения об изменениях подвида гистона Н1 [259]. Ацетилирование гистонов, которое предположительно изменяет взаимодействие гистон-ДНК и делает ДНК более доступной, снижается по мере старения на 30-70%. В последние годы десятилетиe было опубликовано несколько обзорных работ,в которых обсуждается влияние возраста на транскрипцию [147,295,299,313]. Установлено, что в целом транскрипционная активность клетки при старении организма снижается. Однако уровень общей РНК остается постоянным за счет снижения скорости обновления РНК. В большинстве исследований была найдена хорошая корреляция между связанными с возрастом изменениями уровней видов мРНК и уровнем белка (или энзиматической активностью), обусловленным различными видами мРНК. Это было показано на печени крыс в отношении альбумина, альфа(2
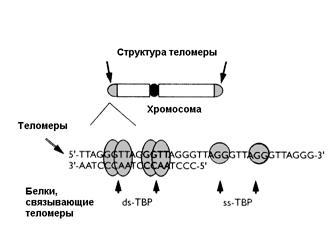
2.2.6. "Предел Хейфлика", теория маргинотомии, теломеры и теломераза Около 100 лет тому назад в связи с развитием методов поддержания клеток in vitro со всей остротой встал вопрос о том, ограничен ли потенциал клеток многоклеточного организма. A.Каррель культивировал фибробласты сердца куриных эмбрионов в культуре в течение 34 лет, при этом клетки прошли тысячи делений без изменений их морфологического строения или скорости роста [165]. Эти опыты встретили серьезные возражения. В частности, указывалось, что несовершенство методов культивирования приводило к внесению свежих клеток в культуры при каждом их пересеве. С другой стороны, онкологам хорошо известны многочисленные штаммы перевиваемых in vivo и in vitro опухолевых штаммов и линий, которые поддерживаются в течение многих лет, иногда десятков лет, клетки которых являются практически бессмертными (иммортализированными). Наряду с этими опытами, появились наблюдения о том, что в клеточных культурах все же не удается длительно поддерживать клетки, полученные из нормальных, не опухолевых тканей. В 1961 г. L.Hayflick и P.S.Moorhead [221] представили данные о том, что даже в идеальных условиях культивирования фибробласты эмбриона человека способны делиться только ограниченное число раз (50 +/-10). Было установлено, что при самом тщательном соблюдении всех мер предосторожности при пересевах клетки проходят in vitro ряд вполне морфологически различимых стадий (фаз), после чего их способность к пролиферации исчерпывается и в таком состоянии способны находиться довольно длительное время. В повторных опытах это наблюдение было многократно воспроизведено, последняя фаза жизни клеток в культуре была уподоблена клеточному старению, а сам феномен получил по имени автора название лимита Хейфлика. Более того, оказалось, что с увеличением возраста донора число делений, которые были способны совершить клетки организма, существенно уменьшалось, что привело к представлению о существовании гипотетического счетчика делений, ограничивающего общее их число [220]. В 1971 г. А.М.Оловников [89] на основании появившихся к тому времени данных о принципах синтеза ДНК в клетках предложил гипотезу маргинотомии, объясняющую механизм работы такого счетчика. Этот механизм заключался, по мнению автора гипотезы, в том, что при матричном синтезе полинуклеотидов ДНК-полимераза не в состоянии полностью воспроизвести линейную матрицу, реплика получается всегда короче в ее начальной части. Таким образом, при каждом делении клетки ее ДНК укорачивается, что, подобно шагреневой коже, ограничивает пролиферативный потенциал клеток и, очевидно, является тем "счетчиком" числа делений и, соответственно, продолжительности жизни клетки в культуре (рис.1). В 1972 г. Ж.Медведев [258] показал, что повторяющиеся копии функциональных генов могут управлять или запускать процесс старения. Открытие в 1985 году теломеразы - фермента, который достраивал укороченную теломеразу в половых клетках и клетках опухолей, обеспечивая их бессмертие [213], вдохнуло новую жизнь в гипотезу Оловникова. Было выполнено огромное количество работ, в которых были установлены следующие основные факты [52,90,198,212,217,220,266,271,290,338,346]: Недавно было установлено, что при введении гена теломеразы в клетки фибробластов человека, которые в норме делятся лишь 75-80 раз, они способны поделиться 280 раз и без каких либо признаков старения и патологии. Тщательное исследование показало отсутствие в этих клетках таких признаков малигнизации, как нестабильность хромосом, независимый от добавления натуральной сыворотки рост, отсутствие контактного торможения и потеря контроля клеточного цикла [160,264]. В другой работе также было показано, что иммортализованные теломеразой фибробласты, прошедшие по крайней мере в два раза больше удвоений, чем нормальные, не проявляют признаков злокачественного роста in vitro, но, что особенно важно, из них не развиваются опухоли при трансплантации бестимусным мышам [159,229]. Полученные данные свидетельствуют о том, что экспрессия теломеразы в культуре клеток человека совсем не обязательно вызывает развитие рака, то есть лишена свойств онкогена, которые ей приписывали. Видимо, основным свойством теломеразы является контроль клеточного деления, а для возникновения опухолевого роста необходимы дополнительные мутации и факторы. Доказательства правомочности такого предположения недавно были представлены T.Kiyono и соавт. [237], которые показали, что введения каталитического компонента теломеразы hTERT или теломеразной активности с помощью онкобелка вируса папилломы человека Е7 в кератиноциты или клетки эпителия человека недостаточно для их полной иммортализации. Она наступает лишь при дополнительном торможении регуляции антионкогена Rb/p16 или при угнетении экспрессии p16 в качестве второй важнейшей ступени этого процесса. Элиминация антионкогена р53 таким свойством не обладала. C другой стороны, протоонкоген c-Myc может активировать экспрессию теломеразы [333], а введение онкогена v-Ha-RAS дрожжам увеличивает продолжительность их жизни [169]. Важные данные получены в Институте молекулярной биологии им.В.А.Энгельгардта РАН [см. 52]. С помощью опосредованного микроклетками переноса маркированную геном neo хромосому 20 из стареющих и молодых диплоидных фибробластов человека ввели в молодые фибробласты. Во всех новообразованных клонах наблюдалось уменьшение пролиферативного потенциала на 17-18 удвоений популяции. Авторы склонны рассматривать полученные данные как свидетельство того, что отдельные теломеры способны ограничить пролиферативный потенциал клеток. Показано, что старение некоторых тканей, например, эпителиальных клеток слизистой полости рта или роговицы глаза человека in vivo, не сопровождается укорочением теломер [191,235]. Экспрессия белка аденовируса 12 Е1В 54К в нормальных клетках человека сопровождалась существенным увеличением их пролиферативного потенциала (до 100 удвоений). Когда затем деления все же прекратились и клетки перешли в фазу старения, то какого-либо существенного укорочения их теломер выявлено не было [205]. Экспрессию активности теломеразы наблюдали в печени крыс после частичной гепатэктомии [325], то есть в процессе регенерации. Не удалось наблюдать существенных изменений в продолжительности жизни или развитии мышей с "выключенным" (knockout) геном теломеразы [246]. Однако недавно было показано, что выключение гена теломеразы все же приводит к сокращению продолжительности жизни мышей, уменьшению устойчивости к стрессу и увеличению частоты развития новообразований [301]. Авторы отметили, что в остальном физиологические и биохимические параметры животных не свидетельствовали об ускорении у них старения. 2.2.7. Апоптоз и продолжительность жизни Установление роли соматических мутаций и репарации ДНК в механизмах старения ставит вопрос о их непосредственной связи с процессами дифференцировки и программированной клеточной гибели (апоптоз) и злокачественного роста. Если у одноклеточных организмов лишь репарация повреждений ДНК позволяет им выжить при изменении условий окружающей среды, то у Metazoa оптимальная стратегия в отношении клеток, несущих повреждения ДНК, не столь однозначна, поскольку некоторые мутации в генах, регулирующих клеточную пролиферацию, адгезию и апоптоз, могут приводить к развитию злокачественных новообразований, ведущих к гибели организма. Поэтому, для организма в целом, "безопаснее" иметь механизмы элиминации таких генетически поврежденных клеток, чем риск возникновения очагов неконтролируемого автономного роста. Выбор конкретной "стратегии" организма - репарации ДНК, блокады пролиферации или апоптоза, зависит, во-многом, от типа клеток, их локализации, микроокружения, характера повреждающего фактора и степени повреждения. В любом случае, эффективный ответ на повреждение ДНК является ключевым звеном для выживания многоклеточного организма. Выше уже обсуждалась модель клеточного старения Хейфлика и роль теломер и теломеразы в продолжительности жизни клеток in vitro. Использование этой модели оказалось весьма плодотворным для изучения механизмов репликативного старения [164,210]. Прекращение способности пролиферировать клеток в культуре можно было объяснить потерей экспрессии пострепликативных генов, например, репрессией с-myc, или неспособностью фосфорилироваться белка ретинобластомы (RB), или, напротив, увеличением экспрессии антирепликативных генов, например, ингибитора циклин-зависимой киназы (cdk) р21. Недавно было установлено, что находящиеся в фазе репликативного старения фибробласты человека резистентны к апоптозу [331]. Угнетение экспрессии ключевых генов G1 фазы, удерживающих стареющие фибробласты человека от вступления в фазу S клеточного цикла, по-видимому, является тем механизмом, который запускает процесс клеточной гибели. Уровень антиапоптотического фактора bcl2 постоянно высок в таких клетках, при этом не наблюдается протеолиза терминина от формы 90 kDa до 30kDa. Таким образом, репрессия генов G1 фазы, увеличение экспрессии гена анти-апоптоза bcl2 и отсутствие протеолиза преставляется, по образном выражению E.Wang [332], крепким "тройным замком", который предотвращает апоптотическую гибель стареющих фибробластов. Весьма существенна в патогенезе апоптоза роль свободных радикалов и ферментов, участвующих в их метаболизме, в частности, цитохрома с [312]. Закономерен вопрос - имеют ли отношение эти результаты, полученные в опытах in vitro, к реальной ситуации старения in vivo, прежде всего, к старению кожи человека? Недавно было установлено, что в коже пожилых лиц стареющие фибробласты содержатся в большом количестве [183]. Хорошо известна высокая чувствительность кожи пожилых канцерогенному действию ультрафиолета и сниженная способность к заживлению ран [139,144]. Cледует заметить, что еще в 1985 г. P.Ebbesen [189] выявил существенное повышение чувствительности старых мышей к действию промотора кожного канцерогенеза 12-О-тетрадеканоилфорбол-13-ацетата по сравнению с кожей молодых животных. При подкожном введении старым животным самых разнообразных канцерогенных агентов (полициклических ароматических углеводородов, нитрозосоединений, пластмассовых пленок или вируса Молони) саркомы на месте введения развивались с большей частотой и значительно раньше, чем у молодых [139,144]. C другой стороны, стимуляция апоптоза в клетках печени ограничением калорийности питания угнетала развитие пренеопластических узелков в печени у старых крыс и мышей [211,268]. Введение мелатонина стимулировало апоптоз в клетках аденокарцином толстой кишки, индуцируемых 1,2-диметилгидразином, что сопровождалось отчетливым торможением развития опухолей [152], тогда как в постмитотических клетках головного мозга этот геропротектор угнетал индуцированную оксидативным стрессом клеточную гибель [253].
2.2.8. Свободнорадикальная теория старения Одной из наиболее плодотвоpно pазвивающихся в последние годы фундаментальных теоpий является свободноpадикальная теоpия стаpения, практически одновременно выдвинутая D.Harman в 1956 г. [219] и Н.М.Эмануэлем в 1958 г. [132,133,192]. Эта теория объясняет не только механизм старения, но и широкий круг связанных с ним патологических процессов (сердечно-сосудистые заболевания, возрастные иммунодепрессия и дисфункция мозга, катаракта, рак и некоторые другие). Согласно этой теоpии, пpодуциpуемые главным образом в митохондриях клеток молекулы супеpоксида (О2-.), Н2О2, гидpоксильного pадикала (НО. ) и, возможно, синглетного кислоpода ( Показано, что видовая продолжительность жизни прямо коррелирует с активностью супероксиддисмутазы (СОД), содержанием Таблица 3. Факторы, защищающие макромолекулы клеток от повреждения свободными радикалами
В пользу свободнорадикальной теории старения говорят эксперименты в которых трансгенные линии D. melanogaster с дополнительными копиями генов, обеспечивающих избыточную активностьСОД и каталазы, жили на 20-37% дольше контрольных мух, тогда как мухи с избыточными копиями генов лишь одного из этих ферментов антиокислительной защиты таким эффектом не обладали [274]. Недавно было установлено, что трансгенные дрозофилы с избыточной экспрессией гена SOD1 в мотонейронах жили на 40% дольше и были значительно устойчивее к окислительному стрессу, чем мухи, не имевшие этого гена [277]. Витамин Е, мелатонин, хелатные агенты и некоторые синтетические антиоксиданты увеличивали продолжительность жизни не только дрозофил, но и лабораторных мышей и крыс [38,88,219,291,292]. Однако, то обстоятельство, что продукты взаимодействия АФК с макромолекулами постоянно обнаруживаются в органах и тканях организма, свидетельствует о том, что системы антиоксидантной защиты недостаточно эффективны и что клетки постоянно подвергаются окислительному стрессу. Противодействие ему может играть существенную роль в механизме геропротекторного действия эндогенных и экзогенных антиоксидантов.
2.3. ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ СТАРЕНИЯ
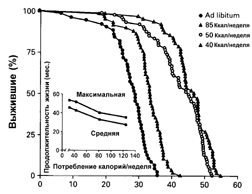
2.3.1. Ограничение калорийности питания и старение В 1914 г. профессор Харьковского университета (а до этого -С.-Петербургского ун-та) Е.А.Шульц, изучая регенерацию гидр и планарий (в том числе вызванную голоданием), пришел к выводу, что в ходе этого процесса клетки животных дедифференцируются и переходят в эмбриональное состояние, т.е. молодеют. Скорость же старения ткани по его мнению зависит от того, как часто она подвергается физиологическому обновлению, периодически голодающие животные достигают большей продолжительности жизни, чем неголодающие. Взгляды Шульца были достаточно известны в первой четверти XX в., однако тогда исследование голодания как фактора продления жизни не получило достаточного развития [109]. В 1917 г. Osborn описал замедление возрастного выключения репродуктивной функции у крыс, содержавшихся в условиях ограниченного питания. В 30-е годы работами McCay было установлено [257], что диета с ограничением калорий увеличивает на 30-50% максимальную и среднюю продолжительность жизни крыс и мышей. До 60-70 гг. этот феномен, хотя и был воспроизведен во многих лабораториях, в том числе и в СССР [86,122], рассматривался как научный курьез. Однако в последующем эта модель, благодаря своей простоте и устойчивой воспроизводимости стала одной из ведущих в изучении фундаментальных механизмов старения и увеличении продолжительности жизни, хотя при этом наблюдалось замедление не всех возрастных биохимических, физиологических и поведенческих параметров [337,344]. Ограничение калорийности питания увеличивало продолжительность жизни также у рыб, амфибий, дафний, насекомых и других беспозвоночных. Хотя до сих пор нет ответа на вопрос - замедляет или нет ограниченная диета возрастные процессы у человека и влияет ли на продолжительность его жизни, в трех больших исследованиях на приматах (главным образом, на макаках резус) получены первые свидетельства тому, что по крайней мере некоторые физиологические эффекты ограниченной по калорийности диеты, наблюдаемые у грызунов, воспроизводятся и у обезьян [167,174,236,244,300]. Среди этих эффектов - уменьшение уровня глюкозы и инсулина в крови, снижение температуры тела, снижение энергозатрат. Было установлено, что именно общее снижение потребления калорий, а не какого-либо ингредиента пищи определяет геропротекторный эффект голодания [337] (рис.3).
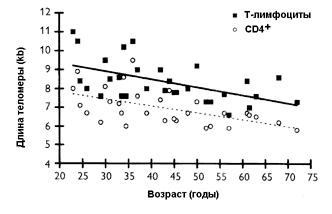
Подсчитано, что 80-90 % из примерно 300 изученных у грызунов, содержащихся на ограниченном по калорийности рационе, разнообразнейших параметров, включая поведение и обучаемость, иммунный ответ, экспрессию генов, активность ферментов и действие гормонов, толерантность к глюкозе, эффективность репарации ДНК, скорость синтеза белка, проявляли черты замедленного старения [315,337,344]. Важно подчеркнуть, что такая диета стимулирует апоптоз, который элиминирует пренеопластические клетки в тканях организма [211,268], замедляет накопление в них мутаций [175] замедляет развитие и возрастной патологии, включая возникновение новообразований [337]. Предполагается, что в механизмах увеличения продолжительности жизни при ограничении калорийности питания основную роль играют такие факторы, как замедление роста, уменьшение содержания жира в теле, замедление нейроэндокринных или иммунологических возрастных сдвигов, увеличение репарации ДНК, изменения скорости биосинтеза белков и экспресии генов, снижение температуры тела и основного обмена, ослабление окислительного стресса. Некоторые из этих механизмов, по-видимому, имеют меньшее, если какое-либо, значение. Так, поскольку ограничение калорийности диеты, начатое в возрасте 12 мес., также увеличивает максимальную продолжительность жизни [337], очевидно, что замедление скорости роста несущественно для продление жизни. Весьма относительно и значение роли снижения содержания жира в теле, поскольку его связь с максимальной продолжительностью жизни у грызунов, содержащихся при питании без ограничения неочевидна, а при ограниченном питании - прямо пропорциональна [337]. Довольно противоречивы данные в отношении роли уменьшения скорости метаболических процессов при ограниченной калорийности питания. Следует отметить, что с помощью некоторых фармакологических средств, в частности, антидиабетических бигуанидов (фенформин, буформин), которые повышают чувствительность тканей к инсулину, улучшают толерантность к углеводам, снижают уровень липидов и устраняют явления метаболической иммунодепрессии, также удается увеличить продолжительность жизни мышей и крыс и снизить у них частоту развития спонтанных новообразований [139,181]. 2.3.2. Иммунологическая теория старения Известно, что с возрастом учащаются случаи различных инфекционных заболеваний, аутоиммунных процессов и опухолей. Возможно, это частично обусловлено возрастными дефектами иммунной системы. Связь столь широкого круга связанных с возрастом патологических процессов с дефектами иммунной системы привела к появлению предположения, что старение иммунной системы может ограничивать продолжительность жизни [329]. Однако, несмотря на то, что выполнено множество экспериментальных и клинических исследований, cвидетельствующих о возрастном истощении иммунной системы, имеющихся данных все же недостаточно для объяснения всех проявлений старения [147,249,251,263,294]. Множество клеточных и гуморальных компонентов, вовлекаемых в иммунные реакции, и большое число модулирующих неиммунных факторов, которые также могут изменяться в старости [215] не позволяют и сегодня нарисовать исчерпывающую картину иммуностарения. Иммунная и гемопоэтическая система тесно связаны, поскольку имеют единое происхождение от Зрелые Т-клетки, лимфоциты (В-клетки) костного мозга и естественные клетки-киллеры (NK-клетки) могут быть определены в крови и лимфоидных органах с помощью специфических моноклональных антител. У человека с помощью этого метода не выявлено существенных изменений соотношения различных субпопуляций лимфоцитов. Однако обнаружены серьезные изменения функционирования Т-лимфоцитов [323]. В то время как общее количество Т-клеток в периферической крови в старости заметно не изменяется, наблюдаются четкие различия в относительном количестве подтипов Т-клеток [249,294,323]. Количество незрелых лимфоцитов Т-предшественников увеличивается с возрастом, так же как и процент частично активированных Т-лимфоцитов, несущих маркеры незрелого фенотипа тимуса. Имеет место относительное увеличение цитотоксических супрессорных Т-клеток и уменьшение количества хелперов/индукторов Т-клеток [249,323]. Функциональные дефекты клеточно-опосредованного иммунитета коррелируют с уменьшением популяции хелперов/индукторов [249]. Клетки, полученные от старых людей или лабораторных животных, менее способны к ответу на аллогенные лимфоциты, фитогемагглютинин, конканавалин А и растворимый антиген. Лимфоциты от более старых мышей обладают меньшей способностью вызывать реакции отторжения, чем те, которые получены от более молодых особей тех же инбредных линий [323]. Половина здоровых людей в возрасте старше 50 лет страдает кожной гиперчувствительностью [48,249]. Уменьшение количества хелперов/ индукторов Т-клеток и функций клеточно-опосредованного иммунитета сопровождается ростом количества антител и аутоиммунных реакций [323]. Труднее выявить возрастные изменения гуморального иммунитета (функция В-клеток) [249]. Исследования влияния возраста на продукцию антител дают противоречивые результаты, возможно, из-за широкой вариабельности этих показателей, характерной для стареющих индивидуумов. Однако твердо установлено, что старение значимо ассоциируется с присутствием различных антител, особенно антител против ядерных антигенов. Получены также доказательства, что старение влияет на скорость продукции антител активированными В-клетками [249]. Что касается функциональных изменений, то их нарушения отмечены на различных уровнях. Во-первых, способность к пролиферации Т-клеток старых индивидуумов, как правило, снижена, вне зависимости от стимуляции (антигенами, митогенами), и дефект касается как снижения числа клеток, отвечающих на стимуляцию, так и преждевременного истощения мощности клона отвечающих клеток [196]. Во-вторых, подавляется ответ на многие интерлейкины, которые физиологически опосредуют модуляцию пролиферативной реакции. Этот феномен был зарегистрирован не только в отношении Т-клеток, но также и для NK-клеток, которые менее чувствительны в старом возрасте к действию интерлейкина-2 или интерферона [287]. В отношении вспомогательных клеток (фагоцитов, макрофагов) известно, что их количество и функция не изменяются с возрастом, а при определенных обстоятельствах оказывается, что их активность усиливается. Важным достижением в изучении механизмов иммуностарения стало установление роли в его развитии возрастных изменений в нервной и эндокринной системах. Связь между нервной и иммунной системами По-видимому, нейроэндокринная система действует не только как модулятор иммунной системы, но также как мишень для сигналов, генерируемых в иммунной системе. Примерами подобных В последние годы было установлено, что некоторые иммуномодуляторы, в частности, пептидные препараты тимуса могут восстанавливать компетентность иммунных клеток в старом организме и увеличивать продолжительность жизни животных [70,81,82,148,150].
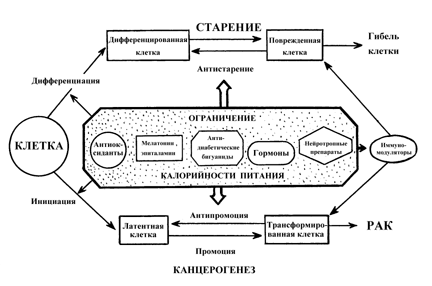
2.3.3. Элевационная теория старения К одной из самых ярких и глубоко разработанных концепций в геронтологии по праву следует отнести элевационную теорию старения и формирования возрастной патологии у высших организмов, придающей ключевое значение в этих процессах возрастному повышению порога чувствительности гипоталамуса к гомеостатическим сигналам [44-48,176-179]. На основании изучения возрастной динамики у женщин таких показателей, как состояние репродуктивной функции, наличие приливов, избыток веса тела и уровень холестерина В.М.Дильман еще в начале 50-х годов выдвинул и обосновал идею о существовании единого регуляторного механизма, определяющего закономерности возникновения и развития в организме в процессе его онтогенеза различных гомеостатических систем. Таким механизмом, по его определению, является возрастное повышение порога чувствительности гипоталамуса к регуляторным гомеостатическим сигналам. На протяжении 60-80-х годов в серии экспериментальных исследований и клинических наблюдений было установлено, что именно этот процесс приводит к возрастному включению и выключению функции репродуктивной системы в женском организме, к возрастным изменениям в гипоталамо-гипофизарно-надпочечниковой системе, обеспечивающей тонический уровень глюкокортикоидных гормонов в крови, их циркадный ритм и повышение секреции при стрессе, и, как следствие, развитию состояния, обозначенному как "гиперадаптоз". Следствием аналогичных возрастных изменений в системе метаболического гомеостата, регулирующего аппетит и энергетическое обеспечение функций организма, является нарастание с возрастом содержания жира в теле, снижение чувствительности тканей к инсулину (пре-диабет) и развитие атеросклероза. Важным этапом в развитии элевационной теории было установление роли возрастных изменений, закономерно возникающих в этих трех основных "супергомеостатах" (репродуктивном, адаптационном и метаболическом), в формировании таких имеющих ключевое значение для продолжительности жизни индивидуума феноменов, как метаболическая иммунодепрессия [177] и канкрофилия, то есть, формирование условий, способствующих возникновению злокачественных новообразований [46,48,178]. Развивая и углубляя на протяжении почти 40 лет свою концепцию, В.М.Дильман пришел к убеждению, что старение (и главные болезни, сцепленные со старением) не запрограммировано, а является побочным продуктом реализации генетической программы развития и поэтому старение возникает с закономерностью, свойственной генетической программе [48,179]. Выдвинутая им онтогенетическая модель развития возрастной патологии открыла новые подходы к профилактике преждевременного старения и болезней, связанных с возрастом и являющихся основными причинами смерти человека (как писал В.М.Дильман "главных" болезней): болезней сердца, злокачественных новообразований, цереброваскулярной патологии, метаболической иммунодепрессии, атеросклероза, сахарного диабета пожилых и ожирения, психической депрессии, аутоиммунных заболеваний, гиперадаптоза и некоторых других. Из онтогенетической модели возникновения болезней следует, что их развитие можно затормозить, если стабилизировать состояние гомеостаза на уровне, достигаемом к окончанию развития организма. Если замедлить скорость старения, то как полагал В.М. Дильман, возможно увеличить видовые пределы жизни человека.
2.3.4. Роль эпифиза в механизмах старения Наиболее существеным для живой природы явлением на Земле является смена дня и ночи, света и темноты. Вращение ее вокруг своей оси и одновременно - вокруг Солнца, отмеряет сутки, сезоны и годы нашей жизни. Все больше сведений накапливается и о роли эпифиза (шишковидной железы) как основного ритмоводителя функций организма. Свет угнетает продуцию и секрецию мелатонина и поэтому его максимальный уровень в эпифизе и крови у человека и животных многих видов наблюдается в ночные часы, а минимальный - в утренние и днем. При старении функция эпифиза снижается, что проявляется прежде всего нарушением ритма секреции мелатонина и снижением уровня его секреции [14,293,324]. Если эпифиз уподобить биологическим часам организма, то мелатонин можно уподобить маятнику, который обеспечивает ход этих часов и снижение амплитуды которого приводит к их остановке. Пожалуй, более точно будет сравнить эпифиз с солнечными часами, в которых мелатонин играет роль тени от гномона - стержня, отбрасывающего тень от солнца [143]. Днем солнце высоко - и тень коротка (уровень мелатонина минимален), в середине ночи - пик синтеза мелатонина эпифизом и секреции его в кровь. При этом, важно то, что мелатонин имеет суточный ритм, то есть единицей его измерения является хронологический метроном - суточное вращение Земли вокруг своей оси. Если эпифиз - солнечные часы организма, то, очевидно, любые изменения длительности светового дня должны существенным образом сказываться на его функциях и, в конечном счете, на скорости его старения. Изменение длительности светового дня существенно модифицирует функции организма, в частности, репродуктивную и иммунную, развитие возрастной патологии и, в конечном счете, может сказываться на продолжительности жизни [143]. Важно отметить, что нарушение циркадианных ритмов с возрастом имеет существенное значение для продолжительности жизни. Недавно было установлено, что хомячки, имеющие специфические мутации taus/+ в циркадианном осцилляторе супрахиазматического ядра (СХЯ) живут меньше, чем их не имеющие такой мутации собратья, тогда как пересадка от них в гипоталамус эмбрионального СХЯ восстанавливают выживаемость мутантов до нормы [225]. В 1959 г. впервые было установлено, что удаление эпифиза в молодом возрасте приводит к существенному уменьшению продолжительности жизни крыс по сравнению с контролем [252]. Эти данные были подтвержены и другими авторами [292]. В 1960 г. румынский геронтолог К.Пархон [91] упомянул в своей книге о продлении жизни старых крыс с помощью вытяжки из эпифиза. В статье, oпубликованной нами в 1973 г. [16], сообщалось о том, что пептидный экстракт эпифиза (получивший позднее название эпиталамин), восстанавливает у старых самок крыс регулярные эстральные циклы и чувствительность их гипоталамических половых центров к эстрогенам - механизм, которому придается ведущая роль в возрастном выключении репродуктивной функции [180]. Тогда же нами были начаты исследования влияния этого препарата на продолжительность жизни самок крыс. Было обнаружено, что эпиталамин увеличивает длительность репродуктивного периода и на 25 % - среднюю продолжительность жизни животных. Более того, он восстанавливает у части старых самок крыс способность к деторождению. Было показано также, что эпиталамин улучшает чувствительность тканей к инсулину, снижает порог чувствительности гипоталамуса к торможению глюкокортикоидами, замедляет возрастное снижение иммунных функций у животных и увеличивает продукцию вилочковой железой ее гормонов. На мышах двух линий было отмечено увеличение почти на треть средней продолжительности их жизни. В этих опытах введение препарата начинали в возрасте расцвета организма, прежде всего, его репродуктивной и иммунной функций - в 3 - 3,5-месячном возрасте, что соответствует примерно 25-30 годам человека. На мышах и крысах были проведены опыты, в которых препарат начинали вводить в возрасте, предшествующем выключению репродуктивной функции. Оказалось, что и в этом случае эпиталамин существенно увеличивал продолжительность жизни животных. Следует подчеркнуть, что во всех упомянутых наших опытах применение эпиталамина наряду с увеличением продолжительности жизни сопровождалось уменьшением частоты развития опухолей [9,17,149]. Эпиталамин эффективно замедлял старение D.melanogaster [151] (рис. 4). Весьма перспективны результаты применения эпиталамина в клинической практике для профилактики преждевременного старения и развития возрастной патологии у человека [81,124,125].
В 1987 г. Pierpaoli и Maestroni [283] сообщили о том, что старые мыши, которым с питьевой водой на ночь давали мелатонин, жили на 20 % дольше контрольных и выглядели явно бодрее последних. Эти данные были воспроизведены на мышах различных линий и крысах, хотя геропротекторный эффект мелатонина не был одинаков и иногда отсутствовал [cм. 9]. Пересадка в вилочковую железу или область эпифиза старых мышей эпифиза от молодых доноров также приводила к увеличению продолжительности жизни животных [247,284]. Основные этапы изучения роли эпифиза в старении приведены в таблице 4. Таблица 4. Основные этапы изучения роли эпифиза как часов старения
Механизмы геропротекторного действия мелатонина и эпиталамина полностью не известны. Существенную роль могут играть способность этих веществ угнетать свободнорадикальные процессы в организме [9,15,125,292,293]. Как мелатонин, так и эпиталамин стимулируют клетки иммунной системы организма и замедляют старение иммунной системы, они нормализуют ряд возрастных нарушений жиро-углеводного обмена, продлевают циклическую деятельность яичников у самок мышей и крыс, восстанавливают репродуктивную функцию у старых животных. Важным, если не самым важным, свойством этих препаратов является их способность предупреждать развитие как спонтанных, так и индуцируемых различными химическими канцерогенами и ионизирующей радиацией новообразований [149].
2.4.1. Старение и чувствительность к канцерогенам В последнее время значительное внимание уделяется анализу связей между старением и молочной железы, кишечника, щитовидной железы и др.), некоторых - повышается (подкожная клетчатка, шейка матки, влагалище) или остается неизменной (легкие, кроветворная ткань). Имеющиеся в литературе противоречия результатов экспериментов обусловлены подчас различиями в схемах опытов с использованием канцерогенов прямого и непрямого действия, различающихся также по химическому строению и механизмам действия; имеют значение и выбранные для сравнения возрастные интервалы и особенности объектов (вид, линия, пол использованных животных) [4,5,138,139,140,144]. Одним из ключевых событий в механизме химического канцерогенеза является образование аддуктов ДНК в тканях-мишенях. В этой связи большой интерес привлекают данные о том, что Кроме того, было показано существенное увеличение с возрастом накопления в ядерной и митохондриальной ДНК метилированного аддукта 7-метилгуанина, что также может играть определенную роль в процессах старения и канцерогенеза [276]. Таким образом, накапливающиеся в литературе данные свидетельствуют о существенных изменениях в строении и функции отдельных структур ДНК, развивающихся в процессе нормального старения. Характер этих изменений различается в разных тканях, что, на наш взгляд, может быть важной причиной неравномерного старения тканей и, соответственно, неодинакового характера возрастного увеличения спонтанных новообразований в различных органах. Это же обстоятельство может играть фундаментальную роль в объяснении неодинакового характера возрастных изменений чувствительности тканей к канцерогенам. В последние годы получены данные, свидетельствующие о том, что не наблюдается универсальной картины изменения с возрастом экспрессии различных протоонкогенов в различных тканях [54]. Так, не было обнаружено корреляции между экспрессией онкогена На-ras в нормальных фибробластах человека и возрастом доноров [317]. Не было различий в экспрессии K-ras, myc или src протоонкогенов и в фибробластах животных разного возраста, хотя у крыс было отмечено возрастное снижение экспрессии в селезенке v-has/bas, v-raf, v-src, но не c-myc, c-myb и актина [199]. Уровень транскрипции c-myc, но не c-sis или c-src увеличивался в печени, но не в мозге крыс с 4 до 22 мес. их жизни [255]. При изучении возрастных изменений метилирования ДНК на генном уровне было обнаружено, что характер метилирования протоонкогена c-myc изменяется у мышей в селезенке и печени, но не в мозге [273]. Эти же авторы показали, что возрастные изменения в метилировании ДНК имеют место лишь в ограниченной тканеспецифичной области гена [272]. Принципиальное значение, на наш взгляд, имеет то обстоятельство, что экспрессия некоторых протоонкогенов и ее возрастная динамика существенно варьируют в различных органах и рис.5).
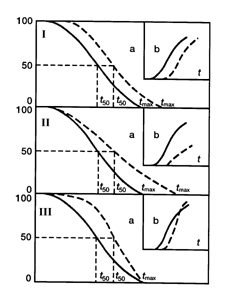
Вещества и воздействия, замедляющие скорость старения популяции, уменьшают частоту и увеличивают латентный период развития новообразований, тогда как при воздействии агентов, ускоряющих старение, т.е. придающих кривой выживаемости более прямоугольный характер, может наблюдаться увеличение частоты развития опухолей, причем, в самых старших возрастных группах). Таким эффектом, например, обладают хелатные агенты, селенит, малые дозы окиси трития. Важно подчеркнуть, что наблюдаемый на протяжении ХХ века у человека тип изменения кривой выживаемости соответствует III типу по приведенной выше классификации, чему и в эксперименте и в эпидемиологических наблюдениях соответствует увеличение заболеваемости злокачественными новообразованиями. Другими словами, за увеличение продолжительности жизни, достигаемое снижением риска умереть в детском и молодом возрасте, человечество "расплачивается" в старости увеличением вероятности развития опухолей и некоторых других болезней цивилизации, в частности, атеросклероза и сахарного диабета. Применение воздействий с антипромоторными свойствами, нормализующих развивающиеся по мере естественного старения гормонально-метаболические и иммунологические сдвиги и тем самым замедляющие реализацию генетических программ старения, может дать наиболее значительный геропротекторный и предупреждающий развитие опухолей эффект [4,5,7,139,144]. Среди таких воздействий наиболее перспективным представляется ограничение калорийности питания, а среди препаратов - препараты шишковидной железы, в частности, эпиталамин [см. раздел 2.9). Следует отметить, что воздействия, направленные на устранение взаимодействия канцерогена с тканями организма и препятствующими инициирующему действию повреждающих агентов (антиоксиданты, антимутагены), могут служить важным дополнительным средством профилактики новообразований и преждевременного старения в условиях повышенного риска воздействия на организм неблагоприятных факторов внешней среды [4,5,7,139,141,144] (рис. 6).
Рассматривая указанные закономерности с точки зрения представлений многостадийной модели канцерогенеза, можно прийти к выводу, что геропротекторы того или иного типа могут замедлять или
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Размещение рекламы | |
|
| |

 Articles
Articles