С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
ГЛАВА 6.4. ТОКСИЧЕСКИЕ ВЛИЯНИЯ НА РЕПРОДУКТИВНУЮ ФУНКЦИЮ. ТЕРАТОГЕНЕЗ
Репродуктивная функция осуществляется как сложноорганизованная последовательность физиологических процессов, протекающих в организме отца, матери, плода. Токсиканты могут оказывать неблагоприятное воздействие на любом этапе реализации функции. Сложность феномена репродукции делает его весьма уязвимым для ксенобиотиков. Трудность познания феномена состоит в том, что нарушение репродукции может быть следствием даже острого токсического действия на различные органы и системы одного из "участников" процесса, в различные временные периоды, а проявляться лишь спустя многие месяцы, а иногда и годы, дефектами зачатия, вынашивания, развития плода и несостоятельностью растущего организма (таблица 1).
Таблица 1. Периоды реализации репродуктивной функции, уязвимые для действия токсикантов.
Предконцептивный период - половое созревание - половое влечение - формирование половых клеток (гамет) - транспорт гамет |
Концептивный период - оплодотворение - имплантация яйцеклетки - развитие плаценты |
Беременность - развитие эмбриона - созревание плода |
Рождение - роды - постнатальный период - лактация |
Рост и развитие ребенка - развитие половых органов - формирование интеллекта Трансплацентарный канцерогенез |
1. Краткая характеристика анатомо-физиологических особенностей репродуктивных органов
Женская репродуктивная система состоит из 4 анатомических образований, функция которых регулируется гормонами, продуцируемыми гипофизом, яичниками, плацентой.
Яичники представляют собой миндалевидный парный орган, локализующийся по обе стороны матки. Функции яичников - овогенез, т.е. образование женских половых клеток (гамет - ооцитов) и продукция стероидных гормонов (эстроген, прогестерон). Оогонии формируются в периоде внутриутробного развития плода будущего женского организма. В организме женщины происходит лишь созревание яйцеклеток. Одна яйцеклетка (ооцит второго порядка) созревает попеременно то в левом, то в правом яичниках женщины раз в два месяца.
Фаллопиевы трубы - каналы, связывающие яичник с просветом матки. Это место слияния мужской и женской половых клеток и путь, по которому овулировавший ооцит перемещается в матку.
Матка - полый орган, с мощными мышечными стенками, расположенный в полости таза. Анатомически матка подразделяется на четыре отдела: дно, тело, перешеек, шейка. Стенка матки состоит из трёх слоёв: эндометрий (слизистая, выстилающая полость матки, в которую имплантируется и где созревает оплодотворенная яйцеклетка), миометрий (мышечная ткань, обеспечивающая выход плода при родах), брюшина.
Влагалище - образование, связывающее полость матки с внешней средой.
Мужская репродуктивная система состоит из четырёх органов, функции которых регулируются гормонами, синтезируемыми гипофизом и семенниками (яички).
Семенники - парный орган, располагающийся в мошонке, в котором образуются мужские половые клетки (сперматозоиды) и синтезируются стероидные гормоны (лейдиговы клетки синтезируют тестостерон). Развивающийся спермий проходит стадии сперматогония, сперматоцита первого порядка, сперматоцита второго порядка, сперматида и спермия. У человека процесс созревания спермия занимает примерно 70 суток.
Придаток яичка - извитая тубулярная структура, связывающая яичко с выносящим канальцем (канал, обеспечивающий выход сперматозоидов в уретру). Функция придатка - обеспечение условий для созревания сперматозоидов и их выхода.
Уретра - канал, в котором выделяют два отдела: простатический и проходящий в половом члене. Уретра связывает выносящий каналец с внешней средой.
2. Развитие плода
Оплодотворение происходит в фаллопиевых трубах и состоит в слиянии женской половой клетки и сперматозоидов. Оплодотворенное яйцо переносится в матку, где имплантируется в эндометрий (период имплантации). В этом периоде, продолжающемся около 2 недель, клетка, в силу большой автономности от организма матери, мало чувствительна к действию токсикантов. Если в этом периоде организм матери повреждается в значительной степени, яйцеклетка погибает, спонтанно абортируется и беременность не диагностируется. После имплантации клетки начинается эмбриональный период развития, продолжающийся до 6 - 7 недели после зачатия. В этом периоде чувствительность к токсикантам особенно велика. В случае их действия на организм матери возможно формирование крупных морфологических дефектов развития плода или его гибель. Вслед за эмбриональным периодом следует период роста плода (фетальный период). В этом периоде чувствительность развивающегося организма к токсикантам постоянно изменяется. Каждый орган плода, формируясь в различное время, имеет свой критический период наивысшей чувствительности к ксенобиотикам. Обычно органогенез завершается в первый триместр беременности, однако развитие гениталий и центральной нервной системы продолжается и после рождения ребенка.
3. Особенности действия токсикантов на репродуктивные функции
Точно выявить механизм, лежащий в основе репродуктивных нарушений, порой практически невозможно, так как ксенобиотик мог подействовать либо на обоих родителей, либо только на одного из них, либо на мать и плод.
Неблагоприятное действие токсикантов (и их метаболитов) на мужские и женские органы репродуктивной системы может быть обусловлено либо нарушением механизмов физиологической регуляции их функций, либо прямыми цитотоксическими эффектами. Так, нарушение гормональной регуляции функций яичников может быть следствием конкуренции ксенобиотиков с половыми гормонами (андрогены, контрацептивные средства), действия на рецепторы эстрогенов (хлорорганические и фосфорорганические соединения), изменения скорости продукции половых гормонов, их метаболизма и выведения (ДДТ, ТХДД, ПХБ, хлордан). Например, полигалогенированные бифенилы нарушают метаболизм половых гормонов. При введении новорожденным крысам, эти вещества существенно изменяют функции печени, значительно изменяя уровень циркулирующих в крови половых гормонов. В последующем это приводит к нарушению оплодотворяемости животных.
Цитотоксичность, как правило лежит в основе поражения половых клеток отца или матери и клеток эмбриона.
Механизм действия многих токсикантов остается неизвестным (сероуглерод, углеводороды). Некоторые из опасных веществ, способных нарушать репродуктивные функции, представлены в таблице 2.
Таблица 2. Вещества, предположительно нарушающие репродуктивные функции
1. Стероиды - андрогены, эстрогены, прогестины 2. Противоопухолевые препараты - алкилирующие агенты, антиметаболиты, антибиотики 3. Психоактивные препараты, вещества, действующие на ЦНС - летучие анестетики (галотан, енфлюран, метоксифлюран, хлороформ) 4. Металлы и микроэлементы - алюминий*, мышьяк, бор*, бериллий, кадмий, свинец (органические и неорганические соединения), литий, ртуть (органическккие и неорганические соединения), молибден, никель, серебро*, селен, таллий 5. Инсектициды - гексахлорбензол, карбаматы (карбарил), производные хлорбензола (метоксихлор, ДДТ), альдрин, дильдрин, ФОС (паратион), другие (хлордекон, этиленоксид, мирекс) 6. Гербициды - 2,4-Д; 2,4,5-Т Родентициды - фторацетат* 7. Пищевые добавки - афлатоксины*, циклогексиламин, диметилнитрозамин, глутамат, производные нитрофурана, нитрит натрия 8. Промышленные токсиканты - формальдегид, хлорированные углеводороды (трихлорэтилен, тетрахлорэтилен, ТХДД*, полихлорированные бензофураны*), этилендибромид, этилендихлорид, этиленоксид, этилентиомочевина, этиленхлоргидрин, анилин, мономеры пластмасс (капролактам, стирол, винилхлорид, хлоропрен), эфиры фталиевой кислоты, полициклическкие ароматические углеводороды (бенз(а)пирен), растворители (бензол, сероуглерод, этанол, эфиры гликолей, гексан, толуол, ксилол), оксид углерода, метилхлорид, диоксид азота, цианокетоны, гидразин, анилин 9. Другие продукты - этанол, компоненты табачного дыма, средства пожаротушения (трис-(2,3-дибромпропил)фосфат), радиация*, гипоксия* |
* - фактор, действующий главным образом на мужчин
Вещества, вызывающие преимущественное повреждение репродуктивных органов мужчины, представлены в таблице 3.
Таблица 3. Вещества, вызывающие преимущественное повреждение репродуктивных органов мужчины
Мишень |
Токсикант |
Сперматогонии Сперматоциты Сперматиды Клетки Сертоли Клетки Лейдига Эпидидимоциты
Добавочные половые железы |
Бисульфан, прокарбазин 2-метоксиэтанол, прокарбазин Метилхлорид Динитробензол, гександион Этан диметилсульфонат Хлогидрин, метилхлорид, этан диметилсульфонат
Имидазол |
На репродуктивные характеристики в постнатальном периоде могут оказывать влияние ксенобиотики, попадающие в организм кормящей матери и выделяющиеся с грудным молоком. Такие вещества, как металлы (ртуть, свинец), тетрахлорэтан, галогенированные ароматические углеводороды (дибензофураны, бифенилы, диоксины), пестициды (ДДТ, диэльдрин, гептахлор и т.д.) могут поступать в организм новорожденного этим путем в больших количествах.
Наиболее часто при нарушениях репродуктивной функции сталкиваются с полигенным (действие на различные органы и системы), многофакторным (действие нескольких токсикантов), синергическим (однонаправленное спонтанное и индуцированное токсикантом нарушение развития) действием.
Основными проявлениями токсического действия химических веществ на органы и ткани, ответственные за репродуктивные функции организма, и непосредственно на плод, являются: бесплодие и тератогенез.
3.1. Тератогенез
Дословный перевод термина "тератогенез" означает "рождение монстров", от греческого teras, означающего "монстр". В древние времена полагали, что рождение деформированного ребенка с аномалиями развития является следствием кровосмешения человека и божества. В средние века, случившийся факт рассматривали как результат происков дьявола, и, как правило, дитя и мать приговаривали к смерти.
Современная тератология как наука начала формироваться в сороковых годах двадцатого века после работ Warknay и сотрудников, показавших, что влияние факторов окружающей среды, таких как диета матери или действие радиации, существенно сказываются на внутриутробном развитии плода млекопитающих и человека. Более ранние исследования, выполненные на рыбах, амфибиях, куриных эмбрионах, показали высокую восприимчивость живых существ к действию неблагоприятных факторов среды, однако оставляли сомнения в том, что и млекопитающие подвержены подобным влияниям. Полагали, что плацента надежно защищает плод от вредных воздействий. В 1950х - 60х годах концепция непреодолимости плацентарного барьера была поколеблена рождением тысяч детей с врожденными дефектами развития, женщинами, принимавшими во время беременности, как казалось, практически безвредный седативный препарат талидомид. Проблема химического тератогенеза стала реальностью.
Тератогенным называется действие химического вещества на организм матери, отца или плода, сопровождающееся существенным увеличением вероятности появления структурно-функциональных нарушений у потомства. Вещества, обладающие тератогенной активностью, называются тератогенами. Существует представление, согласно которому практически любое химическое вещество, введенное в организм отца или матери, в тот или иной период беременности, в достаточно большой дозе, может вызывать тератогенез. Поэтому тератогенами в узком смысле слова следует называть лишь токсиканты, вызывающие эффект в концентрациях, не оказывающих заметного действия на организм родителей. В ходе лабораторных и эпидемиологических исследований установлено, что многие ксенобиотики имеют достаточно высокий потенциал репродуктивной токсичности. Из обследованных примерно трех тысяч ксенобиотиков около 40% обладают свойствами тератогенов.
Существует четыре типа патологии развития плода: гибель, уродства, замедление роста, функциональные нарушения.
Действие токсиканта, сопровождающееся гибелью эмбриона, чаще обозначается как эмбриотоксическое.
3.1.1. Закономерности тератогенеза
В ходе изучения тератогенеза, удалось выявить ряд закономерностей, среди них основными являются: 1) токсикокинетические; 2) генетической предрасположенности; 3) критических периодов чувствительности; 4) общности механизмов формирования; 5) дозовой зависимости.
Особенности токсикокинетики. Тератогенным действием на плод обладают лишь вещества, хорошо проникающие через плацентарный барьер. Многие тератогены подвергаются в организме матери или плода биоактивации (см. раздел "Метаболизм ксенобиотиков").
Генетическая предрасположенность. Чувствительность к тому или иному тератогену существенно различается у представителей различных видов, подвидов и даже индивидов одного и того же вида. Так, кролики и мыши очень чувствительны к кортизону, вызывающему у потомства расщепление неба. У крыс этот дефект при действии вещества не выявляется. К тератогенному действию талидомида чрезвычайно чувствительны люди, высшие приматы, некоторые лини кроликов-альбиносов; отдельные линии крыс и мышей реагируют только на очень высокие дозы вещества. Большинство млекопитающих - резистентны к действию токсиканта.
Отчасти этот феномен связан с существенными различиями токсикокинетики ксенобиотиков.
Критические периоды чувствительности. Сложный процесс эмбриогенеза включает пролиферацию, дифференциацию зародышевых клеток, их миграцию в развивающемся организме и, наконец, начало собственно органогенеза. Все эти явления должны следовать в определенном порядке и быть абсолютно согласованны. Первые 2 недели эмбриональной стадии развития человека - период интенсивной клеточной пролиферации. После оплодотворения клетки быстро делятся, формируя малодифференцированные клетки - бластоциты. Затем следуют периоды закладки зародышевых листков и органогенеза. На раннем этапе эмбрионального развития в период быстрой пролиферации клеток (первые 2 недели развития) их повреждение токсикантами, как правило, заканчивается гибелью эмбриона.
Период наивысшей чувствительности к тератогенам, в котором они оказывают наиболее значимое действие на плод и индуцируют появление грубых морфологических дефектов, это период закладки зародышевых листков и начала органогенеза (первые 12 недель эмбрионального развития). Период органогенеза начинается после дифференциации зародышевых листков и завершается формированием основных органов. За периодом органогенеза следуют периоды гистогенеза и функционального созревания органов и тканей плода (таблица 4).
Таблица 4. Критические периоды эмбриогенеза человека. Примеры веществ, оказывающих патогенное действие на плод (J.V. Aranda, L. Stern, 1983)
Периоды |
Анатомические образования/функции |
Примеры веществ |
Органогенез |
- 2 - 7 недели: глаза, мозг, спинной мозг, сердце, дуга аорты, череп, - 3 - 8 недели: конечности, губы - 6 - 10 недели: урогенитальная система, зубы - 7 - 12 недели: пальцы, гениталии, брюшная стенка, небо |
Талидомид
Дифенилгидантион |
Гистогенез |
|
Алкоголь |
Функциональное созревание |
Внешние половые признаки; Вес тела; Поведение |
Тетрациклин |
Продолжительность периодов внутриутробного развития у различных видов млекопитающих представлена в таблице 5.
Таблица 5. Продолжительность периодов внутриутробного развития у различных видов млекопитающих (сутки). Последствия действия тератогенов
Вид |
Имплантации |
Эмбриональный |
Фетальный |
Человек Кролик Крыса Мышь |
6 - 14 6 - 8 6 - 8 5 - 7 |
14 - 56 8 - 16 9 - 17 7 - 16 |
56 - 280 17 - 34 18 - 22 17 - 20 |
Последствия |
пренатальная гибель |
грубые морфологические дефекты |
физиологические и функциональные нарушения |
Тип нарушения, вызванный веществом, определяется стадией развития плода и конкретным временем воздействия. Для того, чтобы некий тератоген вызвал повреждение конкретного органа, плод должен быть подвержен действию этого вещества в период формирования данного органа. Для развития различных органов "критические периоды" отмечаются в разное время после зачатия. Гистогенез и функциональное развитие органа начинаются до завершения периода органогенеза и продолжаются в периоде роста плода. Неблагоприятные последствия действия тератогенов в этом периоде это уже не морфологические дефекты органов и систем, но различного рода функциональные нарушения.
Механизмы формирования. Различные вещества с различным механизмом токсичности, при действии на плод в один и тот же критический период, часто вызывают одинаковые виды нарушений. Из этого следует, что значимым является не столько механизм действия токсиканта, сколько сам факт повреждения клеточных элементов на определенном этапе развития организма, инициирующий во многом одинаковый каскад событий, приводящих к уродствам (рисунок 1)
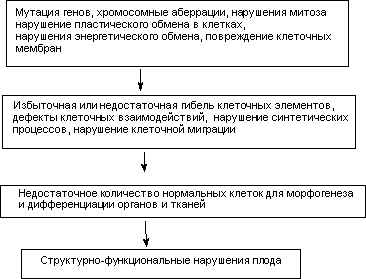
Рисунок 1. Предполагаемые этапы формирования дефектов развития при действии токсикантов на плод
Дозовая зависимость действия. Большинство тератогенов имеют некий порог дозовой нагрузки, ниже которого вещество не проявляет токсических свойств. По всей видимости, появление дефектов развития предполагает повреждение некоего критического количества клеток, выше того, которое эмбрион в состоянии быстро компенсировать. Если количество поврежденных клеток будет ниже этого уровня, действие токсиканта пройдет без последствий, если значительно выше - произойдет гибель плода. Это положение может быть проиллюстрировано результатами исследований тератогенной активности ТХДД, выполненных Moor и сотрудниками (1973) (таблица 6).
Таблица 6. Частота случаев дефектов развития у новорожденных мышат линии C57BL/6 после скармливания беременным самкам ТХДД
Дни беременности |
Доза (мкг/кг) |
Расщепление неба (%) |
Аномалии почек (%) |
Двухсторонняя аномалия почек (%) |
10 - 13 10 - 13 10 10 - 13 |
3 1 1 0 |
55,4 1,9 0 0 |
95,1 58,9 34,3 0 |
83,1 36,3 8,8 0 |
3.1.2. Особенности токсикокинетики тератогенов
Попав в организм матери, вещества распределяются в соответствии с токсикокинетическими свойствами ксенобиотика. Беременность существенно влияет на характер распределения (снижается связывание токсикантов белками, увеличивается объем распределения) и скорость выведения веществ (увеличивается мощность гломерулярной фильтрации) из организма матери. Активность ферментов I и II фаз метаболизма чужеродных соединений снижается.
Токсический эффект ксенобиотиков может зависеть от действия на структуры-мишени их метаболитов, образующихся в организме матери или/и плода. Основным органом биоактивации является печень матери. Однако, образующиеся в ходе метаболизма высоко активные в химическом отношении продукты, быстро реагируют со структурными элементами печени или органами и тканями матери, и не в состоянии достичь тканей плода. Таким образом, действовать на плод могут лишь более стабильные, те есть более инертные в химическом отношении молекулы, образовавшиеся в организме матери, либо реактивные метаболиты, образующиеся непосредственно в тканях плода. Некоторые вещества метаболизируют в плаценте.
Попав в кровоток плода, токсиканты распределяются в его органах и тканях в соответствии с законами токсикокинетики. Многие из них подвергаются метаболизму. В настоящее время установлено, что хотя активность цитохром-Р450-зависимых оксидаз в эмбриональной ткани значительно ниже, чем в ткани печени женщины, она все же достаточна для образования токсичных метаболитов. Способность печеночной ткани плода к метаболизму чужеродных соединений постоянно меняется во времени. Гладкий эндоплазматический ретикулум развивается в клетках плода к 40 - 60 дню беременности. В середине беременности интенсивность метаболизма ксенобиотиков тканями плода составляет 20 - 40% от интенсивности в тканях взрослого человека. В эксперименте показана биоактивация эмбриональной тканью мышей, крыс, кроликов таких тератогенов как бензо(а)пирен, 3-метилхолантрен, диэтилстильбэстрол, 2-диметиламинофлюорен и т.д. Компоненты второй фазы метаболизма развиты у плода не одинаково. Уровень глукуронидирования - низок; энзимы сульфатации, конъюгации с глицином и глутатионом достаточно активны. В связи со сказанным выше, чувствительность плода к токсикантам постоянно изменяется.
3.1.3. Механизмы действия тератогенов
Тератогенный эффект развивается при действии токсиканта в определенной дозе, на чувствительный орган, в определенный период его формирования. Выявлено множество механизмов, посредством которых ксенобиотики оказывают неблагоприятное воздействие. Понимание этих механизмов помогает предвидеть риск, сопряженный с контактом с веществом, корректно экстраполировать данные, получаемые в экспериментах на животных на человека.
Генерация мутаций (мутагенез) - явление модификации токсикантом последовательности нуклеотидов в молекуле ДНК (см. выше). Установлено, что около 20 - 30% нарушений развития плода обусловлено мутациями половых клеток родителей, причем мутаций наследуемых. Мутации соматических клеток плода на ранних стадиях его формирования также чрезвычайно опасны, поскольку изменяют достаточное количество делящихся клеток, для инициации структурных и функциональных дефектов развития. Изменение наследственного кода сопровождается синтезом дефектных белков (ферментов, структурных протеинов), что в свою очередь приводит к функциональным нарушениям, часто не совместимым с жизнью.
Повреждение хромосом - явление разрыва хромосом или их слияния (нерасхождение в процессе митоза). Эти нарушения по современным оценкам являются причиной около 3% нарушений развития плода. Частота повреждения хромосом увеличивается с возрастом матери. Причинами эффекта, помимо химических воздействий, могут быть вирусные инфекции и действие ионизирующих излучений.
Повреждение механизмов репарации. Нарушение свойств генетического аппарата клетки может быть следствием угнетения активности ферментов, обеспечивающих репарацию спонтанно трансформирующихся молекул ДНК (гидроксимочевина, антагонисты фолиевой кислоты).
Нарушения митоза. Митоз - это сложный цитофизиологический процесс, посредством которого делящаяся клетка передаёт дочерним клеткам одинаковый набор хромосом. Многие токсиканты, действуя на специальный клеточный аппарат (клеточное веретено и т.д.) обеспечения нормального митоза, вызывают нарушения процесса (цитозин арабинозид, колхицин, винкристин).
Нарушение биосинтеза жизненно важных молекул может стать следствием действия токсикантов. Многие вещества способны нарушать синтез белка, блокируя процессы репликации (синтез ДНК), транскрипции (синтез РНК) и трансляции (собственно синтез белка). К числу таких веществ относятся многие цитостатики и некоторые антибиотики. По большей части, действие этих веществ приводит к гибели плода; уродства отмечаются значительно реже.
Вещества, затрудняющие поступление в организм матери необходимых для пластического обмена молекул-предшественников и субстратов, являются тератогенами. Нарушения диеты - дефицит в рационе витаминов, минералов, вызывает замедление роста плода, его гибель, приводит к тератогенезу. При этом изменения плода проявляются раньше, чем нарушения здоровья матери. Наиболее известным примером является эндемический кретинизм, характеризующийся замедлением физического и умственного развития в регионах с низким содержанием йода в воде и почве. Дефицитные состояния могут развиться при поступлении в организм веществ-аналогов или антагонистов витаминов, аминокислот, нуклеиновых кислот и т.д. Некоторые вещества блокируют поступление необходимых элементов в организм матери и плода. Так, хроническая интоксикация цинком сопровождается существенным снижением поступления в организм меди.
Вещества, способные угнетать активность энзимов пластического обмена в клетках плода, нарушают его развитие.
Нарушение энергетического обмена может привести к тератогенезу или гибели плода. Причинами состояния могут стать блокада гликолиза, повреждение цикла трикарбоновых кислот (йод- и фторацетат, 6-аминоникотинамид), блок электрон-транспортной системы и разобщение процессов окисления и фосфорилирования (цианиды, динитрофенол).
Повреждение клеточных мембрран. Нарушение проницаемости мембран клеток эмбриона может сопровождаться их гибелью и нарушением эмбриогенеза глаз, мозга, конечностей. Полагают, что в основе тератогенного действия таких веществ, как диметилсульфоксид (ДМСО) и витамин А, лежит именно этот механизм.
Таким образом, в основе тератогенеза могут лежать практически все известные механизмы токсического действия ксенобиотиков (см. раздел "Механизмы действия").
4. Характеристика некоторых токсикантов, влияющих на репродуктивные функции
4.1. Талидомид
Талидомид (рисунок 2) один из активнейших, известных, тератогенов для человека.
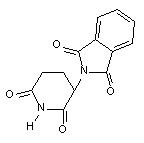
Рисунок 2. Структура талидомида
В 60х годах этот препарат использовали в медицинской практике Германии, Великобритании, других странах Европы и Австралии в качестве седативного средства. Вещество вызывало тератогенный эффект даже в тех случаях, когда применялось однократно с третьей по седьмую неделю беременности в дозах более 0,5 - 1,0 мг/кг. Наиболее частый вид нарушений - фекомелия - укорочение или полное отсутствие конечностей у новорожденных. Зарегистрировано более 10000 случаев фекомелии. Как указывалось выше, существует выраженная видовая чувствительность к препарату. Так, у мышей и крыс токсическое действие не выявляется даже при действии в дозах более 4000 мг/кг.
4.2. Ртуть
Это вещество является выраженным тератогеном для экспериментальных животных. Для человека этот вид токсического действия окончательно не доказан. Хлорид ртути вызывает аборты, однако, трансплацентарное поступление неорганических соединений ртути в организм плода не приводит к врожденным аномалиям. Пары ртути, действуя ингаляционно, вызывают нарушения менструального цикла. Элементарная ртуть также обладает способностью проникать через плацентарный барьер. Повышенное содержание ртути в плаценте и тканях плода обнаружено при обследовании женщин стоматологов, имевших контакт с ртутными амальгамами.
Метилртуть вызывает серьёзное поражение мозга плода, сопровождающееся нейрональной дегенерацией и пролиферацией глии, особенно выраженной в коре мозжечка и конечного мозга. Глубина нарушений зависит от сроков беременности. Особенно опасно воздействие токсиканта во втором и третьем триместре беременности. Некоторые проявления патологических изменений выявляются сразу после рождения, другие, спустя несколько месяцев. Основные симптомы поражения: спастичность, гипотония, микроцефалия, нарушение движения глазных яблок (нистагм, стробизм), умственная отсталость, нарушение роста зубов. Отсутствуют данные о дозовой нагрузке, приводящей к патологии.
4.3. Свинец
То, что металл влияет на репродуктивные функции, известно более 100 лет. На 12 - 14 неделях беременности вещество начинает проникать через плаценту. При длительном действии на организм матери свинец накапливается и в тканях плода. Последствиями этого являются: аборты, преждевременные роды, перинатальная гибель. Имеются сообщения о неврологических нарушениях у детей, рожденных женщинами, в крови которых содержание свинца более 10 мг/ дл. Данные о способности свинца вызывать врожденные уродства отсутствуют.
Действие свинца на отцов также пагубным образом сказывается на развитии плода, однако пока не ясно, является ли это следствием прямого влияния на сперматогенез (хромосомные аберрации, снижение числа сперматозоидов, изменение их формы и активности). Не исключено, что в ряде случаев, причина нарушений - поражение матери в домашних условиях свинцовой пылью, приносимой отцом с производства.
Дети, подвергшиеся воздействию свинца в утробе матери, требуют длительного и постоянного контроля состояния их здоровья. Необходимо контролировать количество свинца в плазме крови, протопорфиринов в эритроцитах, оценивать неврологический статус.
4.4. Кадмий
В лабораторных условиях периодически наблюдаются эффекты, связанные с действия кадмия на репродуктивные функции экспериментальных животных. Эффект зависит от дозы вещества, вида лабораторного животного, периода воздействия. Экстраполяция данных, в этой связи, на человека весьма затруднена. Основываясь на экспериментальных данных, полагают, что тератогенное действие Cd-содержащих веществ может быть связано с ингибированием активности карбоангидразы. Установлено также, что кадмий способен накапливаться в плаценте и вызывать её повреждение.
Данные, полученные при обследовании людей менее убедительны. Только при действии вещества в высоких дозах иногда отмечается повреждение семенников, тератогенез.
4.5. Полигалогенированные бифенилы (ПГБ)
Эта группа химических веществ включает более ста наименований. Соединения используются в качестве изолирующих жидкостей, теплообменников, химических добавок к маслам и т.д. Как правило, коммерческие препараты представляют собой смесь веществ, включая более токсичные дибензофураны.
В условиях лаборатории тератогенное действие ПГБ выявляется постоянно. Имеются данные, согласно которым поступление веществ в организм женщины в течение первого триместра беременности в дозе 1000 - 1500 частей на миллион, приводит к врожденным уродствам плода. Кроме того, отмечались: мертворождение, замедление внутриутробного развития плода, экзофтальм, гиперпигментация кожи, очаговая кальцификация костей черепа при рождении. Наблюдение за такими детьми показывает, что врожденные аномалии разрешаются в течение нескольких лет, однако признаки неврологических нарушений остаются. Возможно поражение ПГБ в постнатальном периоде, при поступлении веществ в организм с молоком кормящей матери. В литературе отсутствуют данные позволяющие установить количественные характеристики рассматриваемых эффектов у человека.
4.6. Органические растворители
В условиях опыта на лабораторных животных удается выявить неблагоприятное действие растворителей на репродуктивную функцию. В этой связи органические растворители рассматриваются как тератогены для экспериментальных животных.
Имеются единичные наблюдения, когда действие органических растворителей на женщин в период беременности приводит к появлению ряда врожденных дефектов, включая недоразвитие ЦНС, заячьей губы и малому весу новорожденных. По другим данным воздействие растворителей на мужчин сопровождается снижением либидо, импотенцией, аномалиями сперматозоидов, а на женщин - нарушением менструального цикла, понижением продуктивности, спонтанными абортами, преждевременными родами. Ни один из выявленных эффектов не является строго научно доказанным.
4.7. Цитостатики
Средства химеотерапии новообразований обладают свойствами тератогенов, если их действие приходится на ранний период беременности. Среди установленных тератогенов: алкилирующие агенты (бисульфан, хлорамбуцил, циклофосфан, мехлорэтамин) и антиметаболиты (аминоптерин, азасерин, азатиоприн, азауридин, циторабин, 5-фторурацил, метатрексат). Риск родить ребёнка с врожденными дефектами у женщин, принимающих цитостатики в терапевтических дозах составляет 1 : 10 - 1 : 50, в зависимости от применяемого средства. Действие веществ проявляется спонтанными абортами, мертворождением, высокой смертностью новорожденных. Дефекты развития у детей включают нарушения со стороны ЦНС, костей лицевого и мозгового черепа, аномалии развития почек и мочеточников, конечностей. Отмечено, что среди медицинских сестер, родивших детей с аномалиями развития, вероятность контакта с цитостатиками в 2,6 раза выше, чем в группе сестер, родивших нормальных детей. У медицинских работников, постоянно контактирующих с цитостатиками, в клетках крови обнаруживается повышенная частота хромосомных аберраций.
С другой стороны отсутствуют убедительные данные, указывающие на неблагоприятное действие цитостатиков (по показателю "увеличение риска тератогенеза") на организм отца до, или в период, зачатия.
5. Выявление действия токсикантов на репродуктивную функцию.
5.1. Экспериментальное изучение
Оценить токсическое действие веществ на репродуктивные функции чрезвычайно сложно, поскольку многообразны и сложны механизмы и условия, приводящие к неблагоприятному эффекту. В настоящее время разработано большое количество протоколов опытов, в рамках которых подобные исследования выполняются. Обычно они осуществляются в четыре этапа:
1. Изучение оплодотворяемости и общей репродуктивности - в опытах на одном поколении животных;
2. Изучение оплодотворяемости и общей репродуктивности - в опытах на нескольких поколениях животных;
3. Изучение тератогенной активности веществ;
4. Выявление перинатальной и постнатальной токсичности.
Опыты выполняются на животных, содержащихся в строго контролируемых условиях.
Изучение оплодотворяемости и репродуктивности. Опыты выполняют на лабораторных животных, как правило, крысах. Обычно 20 самцам (на каждую из исследуемых доз) вводят изучаемый токсикант в течение 60 суток до спаривания, а также 20 самкам - в течении 14 суток до спаривания. Временные периоды выбраны исходя из сроков завершения полного цикла процессов сперматогенеза и овуляции. После спаривания животных обработка токсикантом самок продолжается весь период беременности и до момента прекращения лактации.
Изучаемое вещество добавляют в корм или питьевую воду. Дозовая зависимость определяется в диапазонах: дозы, вызывающие пороговые токсические эффекты у животных-родителей (максимальная исследуемая) - дозы, действующие в естественных условиях на человека (минимальная исследуемая). После спаривания самцов умерщвляют и исследуют; половину самок умерщвляют в середине периода вынашивания и обследуют на предмет оценки преимплантационной и постимплантационной летальности плода. Другой половине самок предоставляют возможность выносить и выкормить потомство. После завершения периода выкармливания крысят умерщвляют и подвергают обследованию с целью выявления дефектов развития. В контрольных экспериментах спаривают животных не подвергшихся действию токсикантов (только самцы, только самки, оба родителя).
Выраженность токсического действия исследуемого вещества на репродуктивные функции оценивают по следующим показателям:
- преимплантационная гибель - количество желтых тел в яичниках, относительно числа мест имплантации яйцеклеток в матке;
- постимплантационная гибель - количество участков резорбции яйцеклеток в матке, относительно общего числа мест имплантации;
- морфологические изменения в репродуктивных органах животных;
- продолжительность периода беременности;
- численность приплода и его состояние, соотношение живых и мертвых новорожденных крысят, вес крысят, наличие видимых уродств;
- характеристика развития новорожденных: прибавка в весе, смертность и т.д.
- наличие морфологических дефектов формирования органов и тканей у крысят после завершения выкармливания матерью.
Все показатели оцениваются количественно, обрабатываются статистически и сравниваются с контролями. Существенные, статистически достоверные нарушения хотя бы одного из оцениваемых показателей свидетельствует о репродуктивной токсичности исследуемого вещества.
Значительно более трудоемким является протокол исследования, предполагающий проследить неблагоприятный эффект в нескольких поколениях. Основная сложность состоит в правильном формировании исследуемых групп и групп сравнения. С содержанием таких протоколов можно познакомиться в специальной литературе.
Изучение тератогенной активности. В ходе исследования токсикант можно вводить весь период беременности, от зачатия до родов. Однако обычно ограничиваются изучением последствий действия вещества в период наибольшей чувствительности плода - период органогенеза. Опыты выполняют, как правило, на грызунах, чаще крысах. Способ назначения и дозы токсиканта - аналогичны, описанным выше. Наиболее типичная форма протокола представлена в таблице 7.
Таблица 7. Типовой протокол исследования тератогенной активности и перинатальной/постнатальной токсичности
ТЕРАТОГЕНЕЗ
Самки
Самцы |
СПАРИВАНИЕ |
ВЫНАШИВАНИЕ
Самкам в течение 6 - 15 дня беременности вводят токсикант.
Мать и потомство умерщвляют на 20 сутки |
ПЕРИНАТАЛЬНАЯ/ПОСТНАТАЛЬНАЯ ТОКСИЧНОСТЬ
Самки
Самцы |
СПАРИВАНИЕ |
ВЫНАШИВАНИЕ
Самкам, начиная с 15 дня беременности, вводят токсикант |
ЛАКТАЦИЯ
Введение токсиканта до завершения лактации (21 сутки). Умерщвление матери и потомства
|
В процессе исследования оценивают структурные нарушения развития плода (таблица 8), величину эмбрио-фетальной летальности.
Таблиц 8. Некоторые аномалии развития, выявляемые входе оценки тератогенности ксенобиотиков
А. Дефекты, выявляемые при общем осмотре 1. Череп, головной и спинной мозг - энцефалоцеле - протрузия мозга через дефекты костей черепа - экзэнцефалия - отсутствие костей черепа - микроцефалия - малые размеры головы - гидроцефалия - увеличенные объемы желудочков мозга - spina bifida - несращение дуг позвонков 2. Нос - увеличение носовых ходов - отсутствие носовой перегородки 3. Глаза - микрофтальмия - малый размер глаз - анофтальмия - отсутствие глаз - отсутствие век 4. Челюсти - микрогнатия - малый размер нижней челюсти - агнатия - отсутствие нижней челюсти - аглоссия - отсутствие языка - астомия - отсутствие ротового отверстия - расщепленная губа 5. Небо - расщепленное небо 6. Конечности - микромелия - укорочение конечностей - гемимелия - отсутствие отдельных костей конечностей - фокомелия - отсутствие всех длинных костей конечностей |
Б. Дефекты внутренних органов 1. Кишечник - пупочная грыжа - эктопия кишечника - экструзия кишечника за пределы брюшной полости 2. Сердце - декстрокардия - расположение сердца в правой стороне грудной полости 3. Легкие - увеличение легких - уменьшение размеров легких 4. Почки - гидронефроз - почки увеличены, заполнены жидкостью - агенезис - отсутствие одной или обеих почек - нарушение формы органа |
В. Нарушения скелета 1. Пальцы - полидактилия - наличие дополнительных пальцев - синдактилия - срастание пальцев - олигодактилия - отсутствие одного и более пальцев - брахидактилия - укорочение пальцев 2. Ребра - дополнительные ребра - сросшиеся ребра - разветвление ребер 3. Хвост - укорочение хвоста - отсутствие хвоста - нарушение формы хвоста |
Поскольку практически все выявляемые нарушения встречаются и у интактных животных, а также могут быть вызваны факторами не химической природы, большое внимание необходимо уделять формированию репрезентативных контрольных групп и статистической обработке получаемых результатов.
В качестве дополнения к предлагаемому протоколу рассматривается возможность использования методов оценки функционального состояния животных, родившихся от самок, подвергшихся воздействию исследуемого химического вещества. Постнатальная оценка функционального состояния животных включает определение скорости роста, состояния почек, печени, сердечно-сосудистой, дыхательной систем, ЦНС.
Изучение перинатальной и постнатальной токсичности. Исследование выполняют на беременных самках белых крыс (таблица 7). 20 животным (на каждую исследуемую дозу) вводят исследуемый препарат в течении последней трети беременности и периода лактации. Способы введения и дозы испытываемых веществ подбирают по общим правилам (см. выше). Оценивают продолжительность беременности, число и размеры новорожденных, скорость роста приплода и т.д. Целесообразно использовать морфологические и физиологические методы оценки состояния здоровья крысят. Результаты обрабатывают статистически и сравнивают с контролями.
Установление тератогенности ряда токсикантов рождает представление о том, что основной причиной дефектов развития являются производственные факторы и факторы окружающей среды. На самом деле это не так. Реальная оценка потенциальной опасности токсиканта для человека - сложная задача. Хотя в опытах на животных проделана большая работа по выявлению тератогенов, мутагенов, веществ нарушающих репродуктивную функцию, полностью переносить полученные данные на человека не представляется возможным. Такой перенос невозможен в силу целого ряда обстоятельств: различий в строении генома у представителей видов лабораторных животных и человека; различий чувствительности развивающихся тканей к отдельным токсикантам; межвидовых различий токсикокинетики ксенобиотиков, включая особенности метаболизма (это имеет значение поскольку у разных видов возможно образование различных метаболитов одного и того же токсиканта, могут существенно различаться временные параметры действия веществ); различием физиологических механизмов реализации репродуктивной функции, продолжительности отдельных периодов развития плода и т.д.
5.2. Оценка риска поражения
Теоретически оценить риск нарушения репродуктивной функции можно только с учетом дозовых нагрузок ксенобиотика, поскольку, как сказано выше, практически отсутствуют вещества безопасные при любых условиях воздействия и в любых дозах. Однако на практике сделать это применительно к человеку в настоящее время не представляется возможным. Чрезвычайно сложная методология получения данных для построения зависимостей "доза-эффект", применительно к рассматриваемой проблеме, не позволяет накопить необходимую для этого информацию.
В этой связи оценка риска поражения и диагностика действия токсиканта на репродуктивную функцию людей строятся на комплексном изучении состояния здоровья, конкретных обстоятельств жизни и работы обследуемых.
Признаки нарушения репродуктивных функций могут быть различными, но всегда следует брать под контроль любой выявленный случай. Возможны, в частности, обращения к врачу по поводу получения информации об опасности тех или иных токсикантов, с которыми отцу или матери приходится сталкиваться на производстве. При этом, работающий может предъявлять жалобы на состояние здоровья, что, по его мнению, указывает на пагубное действие некоего вещества (веществ). Достаточно часто за консультацией обращаются бесплодные супружеские пары, с просьбой решить не является ли причиной их беды тот или иной токсикант, с которым контактирует один или оба супруга. Наконец, поводом для исследования могут стать просьбы родителей проконсультировать их о возможных причинах дефекта развития их ребенка.
Во всех подобных случаях врачу необходимо обследовать пациента, документировать все предъявляемые жалобы, выявить последовательность появления симптомов, степень их выраженности, продолжительность. Желательно опросить, и в случае необходимости, осмотреть сослуживцев пациента на предмет выявления у них аналогичных проявлений. Следует обращать внимание на возможность действия на женщину "непроизводственных токсикантов" в быту (растворители, моющие средства, косметика, вредные привычки, приём лекарств и т.д.). Важной информацией для принятия решения являются данные о возрасте, профессии пациентов, перенесённых заболеваниях.
Ретроспективная оценка возможного токсического воздействия не всегда разрешимая задача, поскольку информация предъявляемая пациентами, как правило, носит субъективный характер. Лица с нарушением репродуктивной функции значительно чаше вспоминают факт воздействия "вредности", чем лица, без такового. Выявление времени воздействия токсиканта и установление, в каком периоде беременности это произошло, также основывается, как правило, на опросе, и потому весьма затруднено.
При изучении условий труда обследуемых необходимо обращать внимание на перечень потенциально опасных действующих токсикантов, их количественные характеристики на рабочем месте, принимаемые меры защиты (технические, организационные и т.д.).
Важно установить отсутствие генетических дефектов у родителей и родственников обследуемых. Наиболее часто встречающиеся "спонтанные" нарушения у человека это: анэнцефалия, spina bifida, дефекты конечностей, расщепленное небо, заячья губа, врожденный вывих бедра, пилоростеноз.
Медицинское обследование беременной женщины, подвергшейся (подвергающейся) действию токсикантов, должно быть тщательным и включать исследование состояния плода, особенно его подвижность, частоту сердечных сокращений, размер.
Лучший способ оценки количества подействовавшего токсиканта - определение его самого или метаболитов в биологических средах организма матери (крови, моче), биологических маркеров действия токсикантов (активность ферментов, картина крови, содержание биологически активных веществ и т.д.).
Полезными методами оценки репродуктивных функций мужчины являются: вес тела, размеры тестикул, анализ спермы (количество сперматозоидов, их подвижность, морфология), эндокринные функции (фолликулостимулирующий, лютеинизирующий гормоны, тестостерон, гонадотропин). При обследовании женщин оценивают: вес тела, эндокринные функции (гонадотропин, пролактин, хориоидный гонадотропин, эстроген, прогестерон), цитологические свойства цервикальной жидкости, анатомо-морфологические особенности органов половой системы. В ряде случаев возникает необходимость пренатального обследования плода (ультрозвуковая диагностика, лучевая диагностика, фетоскопия, фетография, амниография, амниоцентез, исследование хориона, анализ фетальной крови, биопсия кожи и печени плода).
5.3. Эпидемиология токсического действия
5.3.1. Анализируемые показатели
Неблагоприятное действие химических веществ на репродуктивную функцию человека, а также частоту и распространённость нарушений и дефектов развития плода и ребенка, вызываемых токсикантами, изучается и эпидемиологическими методами. В ходе подобных исследований количественные данные получают с помощью специальных приемов.
Одним из часто оцениваемых показателей является оплодотворяемость, т. е. характеристика способности женщины стать беременной. Оплодотворяемость характеризует преимплантационные процессы (см. выше) и не позволяет различить токсическое действие веществ на репродуктивные системы мужчин и женщин. Другим показателем, поддающимся измерению, является вынашиваемость. Вынашиваемость определяется способностью выносить жизнеспособный плод и также является общей характеристикой репродуктивных функций в популяции. Этот показатель не различает токсические поражения мужчин и женщин, нормальные и патологические роды, не учитывает преждевременные роды или гибель ребенка после родов. Термин беременность обозначает период вынашивания плода до родов (38 - 40 недель) и характеризует постимплантационный период развития плода.
Оплодотворяемость и вынашиваемость (так называемые интенсивные характеристики репродуктивности) не являются исчерпывающими показателями при оценке неблагоприятного действия токсикантов на репродуктивную функцию. Далеко не всегда достаточно легко диагностировать беременность в ранние сроки и тем более констатировать факт зачатия, что сказывается и на корректности оцениваемых показателей. Установление факта потери плода зависит от корректности установления беременности. Любую тенденцию к увеличению числа абортов, следует оценивать с учетом количества спонтанных выкидышей, частота которых в "нормальных" условиях составляет 20 - 56%. Расчетная величина вероятности спонтанного аборта в различные сроки беременности представлена в таблице 9. Одной из частых причин абортов является формирование хромосомных нарушений у плода.
Таблица 9. Вероятность спонтанных абортов в различные сроки беременности
Время после овуляции |
Вероятность аборта (%) |
Время после овуляции |
Вероятность аборта (%) |
1 - 6 дней 7 - 13 дней 14 - 20 дней 3 - 5 недель 6 - 9 недель 10 - 13 недель |
54,6 24,7 8,2 7,6 6,5 4,4 |
14 - 17 недель 18 - 21 неделя 22 - 25 недель 26 - 29 недель 30 - 37 недель 38 + недель |
1,3 0,8 0,3 0,3 0,3 0,7 |
Третьим часто оцениваемым показателем является частота дефектов развития плода и ребенка. Эти дефекты могут выявляться сразу после родов или спустя достаточное время после рождения. Дефекты могут быть анатомическими, физиологическими (нарушения метаболизма) и поведенческими. Дефекты развития у человека - частое явление. Отдельные типы нарушений выявляются в 5 -15% случаев всех родов. В 2% случаев изменения выражены настолько, что требуют специального лечения. Наиболее часто выявляются дефекты развития ушных раковин, нетипичная пигментация кожных покровов. В целом, частота дефектов развития ненадёжная характеристика тератогенного потенциала токсиканта. Дело в том, что дефекты, связанные с действием ксенобиотиков, встречаются достаточно редко и потому статистически малозначимы. В большинстве случаев причины дефектов остаются невыясненными (таблица 10).
Таблица 10. Причины дефектов развития плода у человека
Неизвестна 65 - 70% Генетические дефекты 20% Токсиканты 4 - 6% Хромосомные нарушения 3 - 5% |
Инфекция у матери 2 - 3% Метаболические нарушения у матери 1 - 2% Патологические реакции у матери до 1% |
Общая оценка репродуктивной токсичности веществ для человека чрезвычайно сложна. Даже результат острого воздействия токсиканта проявляется в данном случае спустя длительное время, иногда годы. Затруднено изучение влияния токсикантов даже на гаметы. Так, оценить влияние токсиканта на сперматогенез можно лишь после созревания сперматозоидов и их эякуляции, а этот процесс растягивается на месяцы. Кроме того нарушения могут быть следствием длительного действия вещества в малых дозах, а проявляться плохо выявляемыми функциональными изменениями, например менопаузой, изменением полового поведения.
5.3.2. Методы сбора информации
Существует несколько методов сбора данных, позволяющих оценить влияние химических факторов окружающей среды на репродуктивную функцию человека. В частности, проводятся корреляционные исследования среди нескольких групп населения с разным уровнем воздействия ксенобиотиков по показателю "частота нарушений репродуктивной функции". Результаты, рассматриваются как свидетельство тератогенности вещества, если в группе с более высоким уровнем ксенобиотической нагрузки определяется более высокая частота дефектов репродуктивной функции. Исследования подобного типа бывают ретроспективными и проспективными (см. раздел "Эпидемиологические методы исследования").
В ходе ретроспективных исследований формируют группы сравнения, в одной из которых, у обследуемых, выявлены нарушения репродукции, в другой - представлены здоровые люди. В дальнейшем изучается в какой степени на представителей этих групп воздействовал оцениваемый фактор. Если интенсивность воздействия фактора на представителей группы риска достоверно выше (по частоте, продолжительности, дозе), делается предположительный вывод о возможном наличии у токсиканта тератогенных свойств. Недостатком исследования является элемент субъективизма, привносимый в метод тем обстоятельством, что формирование групп, в том числе и контроля, осуществляется исследователем.
Проспективные исследования предполагают сравнительное обследование лиц, имевших контакт с оцениваемым фактором и лиц, такового контакта не имевших (возможно сравнение людей, имевших различные степени воздействия), в плане наличия у них неблагоприятных изменений репродуктивных функций. В ходе исследования оценивается состояние исследуемой и контрольной групп за определенный период времени. Фактор рассматривается как значимо действующий, если дефекты репродуктивной функции выявляются значительно чаще в группе риска. Если формирование групп происходит случайным образом, то исследование называется рандомизированным. Результаты рандомизированных исследований в меньшей степени подвержены субъективизму. Однако и они имеют недостатки. Например, не всегда удается в полной мере выявить в группах редко встречающиеся нарушения.
Интервенционные исследования предназначены для установления частоты развития исследуемых нарушений в контрольной группе (подвергшиеся воздействию токсиканта) и группе лиц, в отношении которых проведены превентивные либо лечебные мероприятия. Если в контрольной группе нарушения встречаются чаще, делаются предварительные выводы о этиологической значимости вещества.
Основанием для проведения тщательного изучения тератогенности вещества часто являются сообщения о неблагоприятных последствиях его действия выявляемых в ходе плановых обследований. Сами подобные сообщения не могут рассматриваться как доказательства вредного действия ксенобиотика, поскольку они основаны во многом на субъективной оценке специалиста. Признать гипотезу фактом можно лишь на основании проведения специальных систематических исследований.
5.3.3. Контроль тератогенеза в популяции
Важным элементом деятельности медицинской службы является контроль тератогенного действия ксенобиотиков в человеческих популяциях. Этот контроль может осуществляться в соответствии с программами, удовлетворяющими разработанным критериям.
Уместность. Учитываемые дефекты развития должны быть клинически значимыми. Небольшие нарушения морфологии лица, конечностей и т.д. могут являться признаками, позволяющими выявить тератогенный эффект новых ксенобиотиков. Множественные дефекты развития представляют особый интерес, поскольку многие известные тератогены вызывают комплекс нарушений.
Временная корректность. Большинство уродств является следствием действия ксенобиотиков на плод в первые 2 - 4 месяца беременности и потому выявляются лишь через 5 - 9 месяцев (после рождения). В случае нарушения функций внутренних органов, развития ЦНС, поведенческих дефектов, то их диагностика может произойти значительно позже. Это требует оценивать состояние не только новорожденных, но и детей более старшего возраста.
Чувствительность. Предлагаемые методы обследований должны быть достаточно чувствительными для выявления умеренного увеличения частоты случаев возникновения дефектов (в два и менее раза). Для сравнения получаемой информации необходимы данные о величине исследуемых показателей в других регионах или в данном регионе до момента обследования. Такие данные должны накапливаться в течение достаточно продолжительного времени и включать информацию, подлежащую количественным методам сравнения. Случайно выявляемое увеличение частоты пороков развития в популяции происходит тем чаще, чем меньше статистика предшествующих наблюдений.
Выявляемость причин увеличения частоты нарушений развития. Увеличение числа нарушений развития может быть следствием:
- изменений состава популяции (возрастной состав, социо-экономический статус);
- изменением методологии выявления дефектов развития;
- появлением в среде тератогенных факторов.
Важным условием истинности суждения об увеличении исследуемого показателя является детальных анализ реальных случаев. Если удается обнаружить меньшую частоту дефектов развития в обследуемой популяции (в сравнении с обычной), то следует выявить причины этого. Иногда это может помочь совершенствованию методов проведения превентивных мероприятий в обществе в целом.
Возможность выявлять многофакторные эффекты. Большинство дефектов развития плода многофакторные по своей природе. В этой связи необходимо учитывать, что совместное воздействие нескольких мутагенных факторов, может сопровождаться формированием патерна уродств, не характерных для каждого из действующих агентов. Работая в таких условиях порой сложно установить реальную причину нарушений. Вместе с тем, резкий подъем уровня выявляемых дефектов в популяции быстрее свидетельствует о единственной причине наблюдаемого феномена.
Сравнимость - свойство методологии, применяемой в ходе обследования, представлять данные, которые можно сравнивать с результатами, получаемыми из других источников или центров информации, является одним из важнейших требований к исследованию. Точность в описании и диагностики выявляемых нарушений во многом определяется квалификацией специалистов, привлекаемых к обследованию. В настоящее время приходится сталкиваться с тем, что различные источники (заключения патологоанатомов, педиатрических и хирургических клиник, консультаций), как правило, представляют данные, собранные с различной степенью тщательности и глубины.
Стоимость. Стоимость обследования в основном определяется числом охваченного обследованием контингента и затратами на материальное оснащение. Планируя работу, необходимо ориентироваться на финансовые возможности с тем, чтобы исследование могло быть доведено до конца.
|