С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
РАЗДЕЛ 5. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ТОКСИЧНОСТЬ
ГЛАВА 5.1. ВНУТРИ- И МЕЖВИДОВЫЕ ОСОБЕННОСТИ ОРГАНИЗМОВ И ИХ ВЛИЯНИЕ НА ЧУВСТВИТЕЛЬНОСТЬ К КСЕНОБИОТИКАМ
Представители различных видов живых существ по-разному, как в количественном, так и качественном отношении, реагируют на действие химических веществ (межвидовые различия). Это позволяет создавать с утилитарными целями вещества с "избирательным" действием, т.е. такие, токсичность которых в отношении определенного вида (видов) живых существ во много раз превосходит токсичность для других видов. На этом принципе строится разработка многочисленные пестицидов, антибиотиков и т.д. Представители одного и того же вида также, порой, неодинаково чувствительны к токсикантам (внутривидовые различия).
Неодинаковая токсичность одного и того же соединения для различных организмов обусловлена как наследуемыми, так и благоприобретенными особенностями их морфо-функциональной организмции, сказывающимися на токсикокинетике и токсикодинамике веществ.
1. Генетически обусловленные особенности реакций организма на действие токсикантов
Информация, заключенная в молекулах хромосомной и экстрахромосомной ДНК определяет морфологические, физиологические и биохимические особенности каждой клетки, которые реализуются в ходе её развития и взаимодействия с окружающей средой. Дифференцировавшиеся клетки, принадлежащие к различным органам и системам, используют лишь часть генетической информации, заключенной в ДНК. Она то и определяет, каким образом каждая клетка будет реагировать на токсикант.
Помимо генетических механизмов, чувствительность отдельного организма к токсиканту определяется взаимодействием внутренних факторов (гормональный фон, интенсивность обмена веществ и т.д.) и факторов внешней среды.
1.1. Межвидовые различия
При изучении токсичности веществ на разных видах лабораторных животных, как правило выявляются определенные различия. Для некоторых веществ, например гликозидов (строфантин), фторацетата эти различия весьма существенны, для других (гексахлорциклогексан) - выражены слабо (таблица 1).
Таблица 1. Токсичность (ЛД50 мг/кг) некоторых веществ для животных различных видов
Вид |
Строфантин |
Гексахлор |
Диизопропил |
Фторацетат натрия |
крысы |
50 - 100 |
75 - 88 |
- |
6,9 |
Большие различия выявляются при оценке на лабораторных животных токсичности диоксина (таблица 2).
Таблица 2. Токсичность 2,3,7,8-тетрахлодибензопарадиоксина (ТХДД) для разных видов животных.
Вид животного |
ЛД50, мкг/кг |
Морская свинка |
0,6-2,5 |
Норка |
4 |
Крыса |
22-45 |
Обезьяна |
менее 70 |
Кролик |
115-275 |
Мышь |
114-280 |
Собака |
менее 300 |
Лягушка-бык |
менее 500 |
Хомяк |
5000 |
Летальная доза вещества (ЛД50) - комплексная величина. На её значение оказывают влияние особенности резорбции, распределения, биотрансформации, выведения токсиканта, особенности взаимодействия с биомишенями и формирования токсического процесса. Каждый из упомянутых факторов в зависимости от вида животных может существенно влиять на токсичность ксенобиотика.
1.1.1. Особенности токсикокинетики
1.1.1.1. Резорбция
Квота резорбции вещества через аналогичные пути поступления у представителей различных видов далеко не одинакова. Так, 6-азауридин разорбируется кожными покровами целого ряда лабораторных животных, но не человека. Напротив, актиномицин хорошо всасывается в желудочно-кишечном тракте человека, но не лабораторных животных.
1.1.1.2. Распределение
Часто одно и тоже вещество по-разному распределяется в организмах представителей различных видов. Так, объем распределения пропранолола (в пересчете на 1 кг массы тела) у человека составляет 3,62, обезьян - 0,60, собаки - 1,71, крысы - 5,30, кошки - 1,57. Причинами таких различий являются особенности структуры белков крови, а следовательно и способности связывать ксенобиотики, кровоснабжения отдельных органов и тканей, содержания жира в организме. Вследствие этого, не смотря на введение животным разных видов одинаковой дозы вещества, его содержание в органах-мишенях у этих животных будет различным.
Заслуживает внимания такая характеристика, как диаметр пор гломерулярной мембраны. Так, у человека в почках через барьер не проникают молекулы с массой более 15000, у собаки - 4000, у крысы - 2000.
1.1.1.3. Биотрансформация
Видовые различия характеристик биотрансформации ксенобиотиков по большей части носят количественный, реже качественный характер. Существует обратная связь между массой тела животного и скоростью ферментативного превращения чужеродного соединения, поэтому прямой перенос данных по токсичности вещества, полученных на одном виде животных на другой чреват большой вероятностью ошибки. Мелкие лабораторные животные, как правило, менее чувствительны к токсикантам, чем большие (таблица 3).
Таблица 3. Чувствительность животных различных видов к гексобарбиталу (вводимые дозы -100 мг/кг; для собаки - 50 мг/кг).
Вид |
Время сна (мин) |
период полу- превращения гексобарбитала (мин) |
Активность энзимов (мкг/г/час) |
мыши |
12 |
19 |
598 |
Кошки являются исключением из этого правила. Они метаболизируют вещества чрезвычайно медленно. Многие лекарственные препараты, например, фенитоин, аминазин, дезипрамин, резерпин сохраняются в организме этих животных днями. Действие одной дозы резерпина продолжается в течение 3 недель. Детоксикация ксенобиотиков в организме человека протекает также медленно, причем процесс идет с иной скоростью, чем в организме приматов, не смотря на их эволюционную близость.
Активность энзимов отдельных органов и тканей, участвующих в метаболизме чужеродных соединений у разных видов живых существ, как в отношении различных субстратов, так и отдельных реакций, варьирует в широких пределах (таблица 4).
Таблица 4. Активность бензпирен-гидроксилазы (в условных единицах) и её чувствительность к индукции полициклическими углеводородами в органах лабораторных животных
Животное |
Печень |
Почки |
Легкие |
Кишечник |
Кожа |
Мышь |
11 |
0,03 |
0,2 |
1,0 |
0,7 |
Обезьяна |
2,5 |
0,4 |
0,2 |
0,1 |
0,02 |
Способность энзима к индукции |
|||||
Контроль (1,0) |
1,5 |
10 |
3 - 10 |
6 |
4 - 11 |
(D.W. Nebert, H.V. Gelboin, 1969)
В соответствии с уровнем активности процесса О-деэтилирования этилморфина лабораторные животные могут быть ранжированы следующим образом: морская свинка > мышь > крыса. В отношении N-деметилирования, зависимость иная: мышь > крыса > морская свинка.
Как следует из данных, приведенных в таблице 5, основываясь на данных по активности микросомальных ферментов печени, невозможно оценить a priori скорость метаболизма ксенобиотика.
Таблица 5. Активность процессов биопревращения ксенобиотиков (мкМ метаболита/час/г микросомальных белков; 27о) и содержания цитохромовР-450 и b5 (мкМ/г микросомальных белков) в печени трёх видов животных
Активность |
Мышь |
Морская свинка |
Крыса |
p-NO2-анизол-О-деметилаза |
40 |
70 |
20 |
Другими примерами видовых различий метаболизма ксенобиотиков являются неодинаковое соотношение процессов биологического окисления и конъюгации (таблица 6).
Таблица 6. Видовые различия в скорости отдельных этапов метаболизма дихлорметилена
Вид |
Образование промеж. продуктов при участии Р450; Vmax (мг/час кг) |
Образование конъюгатов при участии |
Соотношение скоростей метаболизма |
Мышь |
12,4 |
1208 |
98 |
Крыса |
2,7 |
91 |
34 |
Хомяк |
6,8 |
26 |
4 |
Человек |
1,4 |
3,4 |
2,5 |
(D.V. Parke et al., 1990)
Действие токсикантов на животных с различным механизмом метаболизма ксенобиотиков будет различным, особенно в тех случаях, когда происходит образование активных метаболитов. Этим обстоятельством, вероятно, можно объяснить резистентность морских свинок к действию канцерогена 2-ацетиламинофлюорена, и мышей к канцерогену афлатоксину В1.
1.1.1.4. Экскреция
Установлено, что видовые различия в чувствительности к веществам слабо метаболизируемым в организме могут быть обусловлены существенными различиями в скорости их выведения. Особенно это касается ксенобиотиков удаляемых с помощью механизма активной секреции в мочу или желчь. Так, оуабаин быстро выводится из организма крыс с желчью, но у собак и кроликов процесс идет медленно. Известно, что скорость экскреции существенно зависит от размеров выделяемой молекулы. У различных видов животных оптимальные значения молекулярной массы токсиканта, выделяемого через почки или печень неодинаковы. Для веществ-анионов, выделяющихся через печень, порог молекулярной массы составляет у крыс около 325, морской свинки - 400, кролика - 475. Для катионов с различной массой молекулы отсутствуют видовые различия в скорости билиарной экскреции: порог выведения для всех упомянутых видов животных составляет 200 - 250.
1.1.2. Особенности токсикодинамики
1.1.2.1. Связывание с рецептором
Первичная структура и конформация рецепторов, взаимодействующих с ксенобиотиками, тем более различаются у представителей различных видов, чем дальше отстоя друг от друга эти виды в филогенезе. В этой связи и сродство токсикантов к рецепторам, выделенным из тканей различных животных и человека неодинаково, как неодинакова и их токсичность. Так, EC50 гликозида оуабаина для Na,K-АТФазы, выделенной из миокарда собаки и быка более чем 350 раз ниже, чем для этого же энзима, полученного из тканей крысы и мыши.
Содержание рецепторов определенного вида в аналогичных тканях животных различных видов также не одинаково. Например выносящий семенной канатик мыши содержит преимущественно ![]() -опиатные рецепторы, крысы и кролика - рецепторы преимущественно
-опиатные рецепторы, крысы и кролика - рецепторы преимущественно ![]() - и
- и ![]() -типов. И этим также обусловлены различия токсичности веществ для представителей разных видов.
-типов. И этим также обусловлены различия токсичности веществ для представителей разных видов.
1.1.2.1. Эффекторные реакции
Строение, физиология, биохимия живых существ, принадлежащих различным классам организмов, глубоко различны. Эти различия носят не только количественный, но и качественный характер, не смотря на известное эволюционное родство организмов. Адаптация живых существ даже близких видов к различным средам обитания, условиям существования, обусловливает особенности их реактивности на внешние раздражители, в том числе и на химические воздействия. Этот факт широко известен. Его обсуждение может быть осуществлено лишь в рамках специального курса по эволюционной токсикологии и выходит далеко за рамки настоящей книги.
1.2. Внутривидовые различия
1.2.1. Генетические особенности личности
Токсичность ксенобиотиков для различных людей колеблется в достаточно широких пределах. Эти колебания обусловлены внутривидовой изменчивостью. В основе изменчивости лежат генетические особенности организмов одного и того же вида. Иногда генетические особенности людей и даже целых семей выражены столь существенно, что это проявляется в их необычайно высокой чувствительности к тем или иным токсикантам, выходящей за рамки доверительного интервала изменчивости популяции. Выяснение причин таких особенностей является предметом токсикогенетических исследований. Как правило повышенная чувствительность обусловлена мутацией генов, отвечающих за синтез некоторых энзимов, регуляторов биотрансформации ксенобиотиков, рецепторных структур или транспортных белков. Выявляемые при этом аномалии могут иметь как моногенетическую, так и полигенетическую природу. До какого-то времени эти аномалии могут не проявляться фенотипически. Их манифестация происходит лишь при контакте организма с определенными токсикантами. В качестве примера можно привести дефекты глюкозо-6-фосфатдегидрогеназы или гемоглобина. Лица с подобными генетическими дефектами реагируют на целый ряд веществ (сульфо-, нитро-, аминосоединения и т.д.) бурным образованием метгемоглобина и гемолизом.
У некоторых лиц с очень низкой скоростью протекает реакция ацетилирования ксенобиотиков и их метаболитов. Так, обычно период полупревращения гидразина и его производных в организме человека составляет 40 - 80 минут. У лиц с низкой скоростью ацетилирования - 150 - 200 минут. Количество лиц с таким дефектом метаболизма в Европе составляет около 50%. Поскольку биопревращение гидразина сопровождается его детоксикацией, число лиц с высокой чувствительностью к данному токсиканту велико. Прием лекарств, синтезированных на основе гидразина, у пациентов с дефектом N-ацетилтрансферазы нередко приводит к развитию полинейропатий. Установлено, что лица с медленным процессом ацетилирования ксенобиотиков гомозиготны по аутосомальному рецессивному гену.
Дефект N-ацетилтрансферазы лежит в основе неблагоприятных реакций на целый ряд медикаментов, таких как фенелзин, дапсон, дигидролазин, прокаинамид, сульфапиридин, нитрозепам и др. (рисунок 1). Так, при приеме такими лицами дигидролазина или прокаинамида в организме могут появиться антинуклеарные антитела, что, в свою очередь, проявляется состоянием, напоминающим диссеменированную форму красной волчанки.
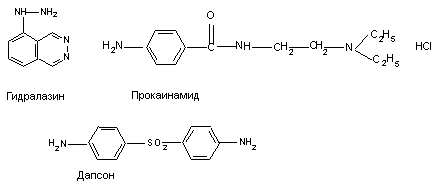
Рисунок 1. Структура веществ, вызывающих у чувствительных лиц состояние, напоминающее красную волчанку
Примерно у 10% европейцев понижена интенсивность N-окисления спартеина и 4-гидроксилирования дибрезохина. У этих же лиц понижена метаболическая активность в отношении ксенобиотиков с близким химическим строением.
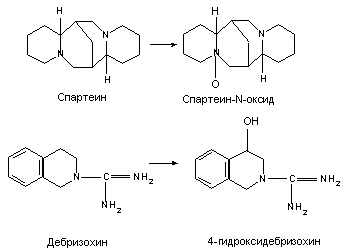
В качестве причин понижения метаболической активности спартеина и дибрезохина рассматривается функциональный дефект или понижение количества изоферментов цитохром-Р-450 зависимых оксидаз.
Еще один вид генетической аномалии удалось выявить при назначении пациентам суксаметониума. Этот миорелаксант в норме разрушается холинэстеразой плазмы крови на холин и янтарную кислоту. Благодаря высокой активности энзима у большинства людей длительность действия препарата исчисляется минутами. Однако у некоторых, при введении установленной дозы вещества развивается длительная миорелаксация и апное. Активность фермента у таких лиц составляет лишь 10 - 20% от нормы, поскольку в крови циркулирует атипичная псевдохолинэстераза. Дефект энзима наследуется по аутосомальному рецесстивному механизму.
Имеются и другие аномалии энзимов, имеющие большое токсикологическое значение. Среди них дефекты: алкогольдегидрогеназы, параоксоназы, каталазы, дофамин-![]() -монооксигеназы, моноаминоксидазы, глютатионсинтетазы, глюкуронозилтрансферазы, катехол-О-метилтрансферазы, тиопуринметилтрансферазы, тиолметилтрансферазы.
-монооксигеназы, моноаминоксидазы, глютатионсинтетазы, глюкуронозилтрансферазы, катехол-О-метилтрансферазы, тиопуринметилтрансферазы, тиолметилтрансферазы.
1.2.2. Различия связанные с полом
Наиболее отчетливо выражены различия в чувствительности самцов и самок к токсикантам у грызунов. Однако выявляемые закономерности справедливы для других млекопитающих и человека. Основная причина феномена - особенности токсикокинетики ксенобиотиков. Так, кожа спины самок крыс примерно в два раза более проницаема для мочевины, бензойной кислоты и кортизона, чем кожа самцов. Существенно различны скорость и характер метаболизма чужеродных соединений. Микросомы, выделенные из гепатоцитов самцов имеют примерно в два раза большее сродство к гексобарбиталу и амидопирину (но не анилину), в сравнении с микросомами печени самок. В этой связи продолжительность действия барбитуратов на самцов меньше, чем на самок. Деметилирование бензфетамина и метиланилина, гидроксилирование бензпирена и анилина, глукуронизирование ряда токсикантов - примеры процессов, протекающих в организме самок с меньшей скоростью, чем в организме самцов.
Кастрация или введение самцам эстрогенов нивелируют различия в скорости метаболизма ксенобиотиков в организме животных разных полов. Напротив, тестостерон, введенный кастрированным самцам, позволяет вновь выявить различия. Показано, что эффект гормона обусловлен в большей степени анаболической составляющей его активности.
В связи с изложенным токсичность многих ксенобиотиков для самцов и самок лабораторных животных, мужчин и женщин - неодинакова.
Различия токсичности веществ при остром и хроническом введении могут иметь разную направленность. Так, при остром введении ЛД50 паратиона для самцов крыс составляет 30 мг/кг, для самок - 3 мг/кг. При хронической аппликации токсичность вещества для самцов, напротив, выше. Это объясняют тем обстоятельством, что при острой интоксикации эффект вещества связан с его антихолинэстеразной активностью, а при хронической - с действием метаболита паратиона, нитрофенола, на систему крови.
Метаболические превращения ксенобиотиков могут различаться не только количественно, но и качественно. Например при интоксикации диельдрином в моче самцов и самок обнаруживаются разные продукты метаболизма. При введении самкам крыс анальгетика тиарамида до 65% вещества выводится с мочой в форме сульфоконьюгата. При введении препарата самцам этот метаболит вообще не обнаруживается в моче.
Различия токсичности веществ, связанные с полом, у человека выражены слабо. Вместе с тем, процесс резорбции некоторых веществ проходит с разной скоростью. Так, у женщин в желудочно-кишечном тракте хуже всасывается салициловая кислота. Ксилокаин хуже, а диазепам лучше связывается с белками крови женщин, чем мужчин. У женщин, как правило, больше жировой ткани, что сказывается на характере распределения гидрофильных и гидрофобных ксенобиотиков. Активность некоторых энзимов, метаболизирующих чужеродные соединения у мужчин и женщин неодинакова. Так, активность эстеразы ацетилсалициловой кислоты у мужчин выше, а моноаминоксидазы - ниже.
2. Не обусловленные генетически особенности реакции организма на действие токсикантов
2.1. Возрастные различия
В процессе индивидуального развития человека и животных выделяют эмбриональный, фетальный, неонатальный, перинатальный, а также периоды созревания, зрелого возраста и старости. Чувствительность организма к токсикантам в эти периоды различна. Это обусловлено процессами развития, созревания и дифференциации тканей, возрастными особенностями морфологии, физиологии и биохимии органов и систем организма. В различные периоды развития и жизни организма подвергаются существенным изменениям: характер вазкуляризации тканей, проницаемости гистогематических и иных барьеров, функции нервной, эндокринной, иммунной систем и т.д. На таблице 7 представлены некоторые различия между организмами, находящимися в разных периодах развития и жизни, сказывающиеся на чувствительности к ксенобиотикам.
Таблица 7. Некоторые функционально-морфологические различия между организмами, находящимися в различных периодах развития и жизни
Различия между неонатальным периодом и зрелым возрастом
1. Резорбция в желудочно-кишечном тракте. Проницаемость для белков (иммуноглобулинов) и других макромолекул возрастает на короткий период сразу после родов. Скорость всасывания чужеродных соединений выше. Кислотность кишечного содержимого понижена. Скорость эвакуации содержимого желудка ниже. 2. Распределение. Более высокое соотношение объемов экстрацеллюлярной/интрацеллюлярной жидкости. Более низкое содержание жировой ткани. Понижена способность белков плазмы крови связывать ксенобиотики. Повышена проницаемость гематоэнцефалического и ликворного барьеров. Более высокая относительная масса мозга и печени. 3. Биотрансформация. Масса гладкого эндоплазматического ретикулума в гепатоцитах в постнатальном периоде возрастает. Биотрансформация чужеродных соединений в целом низка, в постнатальном периоде возрастает. Способность к индукции микросомальных ферментов у новорожденных выше, чем у взрослых. 4. Экскреция. Соотношение масса почек/масса тела у новорожденных в два раза выше, чем у взрослых. Число и размеры почечных клубочков у новорожденных ниже. Фильтрационная способность невысокая, в постнатальном периоде повышена. Канальцевая секреция редуцирована; постепенно повышается в процессе созревания. Скорость реабсорбции выше. Секреция желчи ограничена. |
Различия между периодом зрелости и старости 1. Резорбция в желудочно-кишечном тракте. Постепенное снижение числа резорбирующих клеток. Повышение рН содержимого желудка. Снижение подвижности желудочно-кишечного тракта. Понижение интенсивности обмена в слизистой тонкой кишки. 2. Распределение Уменьшение количества воды в организме. Увеличение количества жировой ткани. Ослабление кровотока в тканях. Снижение проницаемости гистогематических барьеров. Снижение связывающей способности белков крови. 3. Биотрансформация. Частичное снижение метаболической активности пеячени. 4. Экскреция. Незначительное понижение почечной секреции. Замедление почечной экскреции. |
2.2. Влияние массы тела
Более высокая, в сравнении с нормой, масса тела как правило является следствием избыточного накопления жировой ткани. Вещества, накапливающиеся в жире в этом случае действуют слабее. Ожирение нередко сопровождается нарушением функций печени, поэтому у тучных людей характер токсического действия некоторых ксенобиотиков может существенно изменяться.
2.3. Влияние беременности
Во время беременности изменяются многие параметры организма: масса тела, соотношение объемов интра- и экстрацеллюлярной жидкости, содержание жировой ткани, скорость эвакуации желудочного содержимого, концентрация белков плазмы крови, относительный объем сердца, кровоснабжение почек, интенсивность клубочковой фильтрации и т.д. Все это естественно приводит к значительному изменению чувствительности беременных к токсикантам. К тому же измененный гормональный фон сказывается на активности энзимов, участвующих в метаболизме ксенобиотиков. В большинстве случаев практически не возможно предсказать, как измениться токсичность вещества при беременности. Это следует устанавливать в каждом случае экспериментально.
Достаточно подробно изучался метаболизм ксенобиотиков в организме беременных крыс. Установлено, что активность анилингидроксилазы, этилморфин-N-деметилазы, дифенил-4-гидроксилазы, билирубин-глюкуронозилтрансферазы, катехол-О-метилтрансферазы, нитроредуктазы, моноаминоксидазы понижается. Содержание цитохрома Р-450 также снижено. Аналогичные результаты получены и на других видах лабораторных животных, в частности, на кроликах.
|